Bedeutung von LA-MRSA und ESBL-bildenden Enterobacteriaceae bei Masttieren für den Menschen (2.5.2016)
Bedeutung der bei landwirtschaftlichen Nutztieren nachgewiesenen Livestock-assoziierten Methicillin-resistenten Staphylococcus aureus (LA-MRSA) für den Menschen
Dr. Christiane Cuny1, PD Dr. Guido Werner1 und Prof. Dr. Wolfgang Witte2
1Robert Koch-Institut, Bereich Wernigerode,
Nationales Referenzzentrum für Staphylokokken und Enterokokken
2Bereich Wernigerode, RKI Fellow
In Deutschland kam es zwischen 1990 und 2001 zu einem erheblichen Anstieg von nosokomialen Infektionen mit MRSA, die innerhalb und zwischen Krankenhäusern sowie anderen kurativen Einrichtungen verbreitet werden (HA-MRSA)). Seitdem hat die Nachweis-Häufigkeit nicht weiter zugenommen, wobei das EARS-Net (European Antimicrobial Resistance Surveillance Network)) seit 2006 sogar einen leicht rückläufigen Trend ausweist [EARSS, 2012]. Jeweils aktuelle MRSA-Raten können der Antibiotika-Resistenz-Surveillance (ARS) entnommen werden (www.rki.de, https://ars.rki.de/Content/Database/ResistanceOverview.aspx) Demgegenüber sind MRSA-Infektionen, die unabhängig und außerhalb von Einrichtungen des Gesundheitswesens in der Bevölkerung (community) auftreten, in Deutschland vergleichsweise selten. Als Community-MRSA (CA-MRSA) bezeichnet, stehen sie zumeist in Verbindung mit (rezidivierenden) Furunkeln bzw. anderen tiefgehenden Haut-Weichgewebeinfektionen. Wie bei Cuny und Layer (2011) beschrieben werden 10-15% dieser sporadisch auftretenden Infektionen durch MRSA verursacht, die ursprünglich mit Masttieren assoziiert sind, den LA-MRSA. Die Unterscheidung zwischen HA-MRSA (hospital- associated MRSA), CA-MRSA (community- acquired MRSA) und LA-MRSA (livestock- associated MRSA) erfolgt primär aufgrund ihrer jeweils vorrangigen Verbreitung in Krankenhäusern, in der Bevölkerung sowie bei industriell gehaltenen landwirtschaftlichen Nutztieren (Masttiere), obgleich auch Unterschiede in ihren genomischen Eigenschaften vorliegen.
Die Population von S. aureus ist weitgehend klonal aufgebaut, d. h. ein Austausch von Teilen des Genoms zwischen unterschiedlichen Stämmen erfolgt selten. Punktmutationen, die zu unterschiedlichen Allelen führen, erfolgen offenbar 15-mal häufiger als Rekombinationen. Diesbezügliche Schlussfolgerungen beruhen vorwiegend auf Ergebnissen der Multilocus-Sequenz-Typisierung (MLST; Nachweis der Allele von sieben konservierten Genen des Grundstoffwechsels), und die Sequenz-Typen (ST) werden aufgrund der Allelprofile definiert. Isolate, die für mindestens fünf Allele (Zustandsform von Genen) die gleichen Sequenzprofile zeigen, werden einem gemeinsamen klonalen Komplex (CC) zugeordnet. Basierend auf dieser Einteilung gehören etwa 87% aller S. aureus-Isolate aus Besiedlung und Infektionen beim Menschen elf weit verbreiteten klonalen Komplexen an (CC1, CC5, CC8, CC12, CC15, CC22, CC25, CC30, CC45, CC51, CC121). Daraus haben sich unabhängig voneinander HA-MRSA und CA-MRSA durch Erwerb von SCCmec-Kassetten (mobile genetische Elemente) entwickelt, die ein mec-Gen enthalten, wie in einer Übersicht bei Deurenberg und Stobberingh (2009) dargestellt. Mec-Gene (zumeist mecA, seltener mecC) kodieren für ein zusätzliches Penicillin-Bindeprotein, das nur geringe Affinität für ß-Laktamantibiotika besitzt und somit Resistenz gegen nahezu alle Vertreter dieser Substanzklasse verleiht (Ito et al., 2012).
Bei der Betrachtung von LA-MRSA stellt sich die Frage nach der „Wirtsspezifität“ von S. aureus. Bereits vor ca. 50 Jahren durchgeführte vergleichende Untersuchungen (Phänotypie) an S. aureus-Isolaten mit Herkunft von Menschen und Tieren führten zu einer Unterscheidung der sogenannten „Standortvarietäten“ und damit zur Bezeichnung von Ökovaren: hominis, bovis, ovis und gallinae (Meyer, 1967). Die Anwendung moderner Genom-basierter Methoden ermöglichte durch Typisierung und Charakterisierung dieser S. aureus-Isolate die Zuordnung zu klonalen Komplexen, welche vorwiegend beim Menschen nachgewiesen werden (CC8, C15, CC22, CC30, CC45, CC80, CC152). Als Zeichen einer ausgeprägten Wirtsspezifität sind die klonalen Linien ST97 und ST151 vorwiegend mit Wiederkäuern assoziiert, die klonale Linie ST385 bisher ausschließlich mit dem Mastgeflügel (Cuny et al., 2010; Pantosti, 2012). Bestimmte andere klonale Linien besitzen dagegen eine geringer ausgeprägte Wirtsspezifität und treten als Besiedler (vorwiegend des Vestibulum nasi) und als Infektionserreger sowohl bei Menschen als auch bei Tieren auf.
Vergleichende Genomanalysen von Methicillin-empfindlichen Isolaten (MSSA) der klonalen Linie ST5 von Menschen und vom Mastgeflügel und MSSA/ MRSA des klonalen Komplexes CC398 weisen darauf hin, dass im Zuge der Entwicklung von Intensivmast-Haltungen eine Adaptation ursprünglich beim Menschen vorkommender klonaler Linien an Masttiere erfolgte (Lowder et al., 2009; Price et al.,2012). Die damit verbundenen genetischen Veränderungen betreffen weniger das core-Genom, sondern vielmehr mobile genetische Elemente, wie Prophagen und genomische Pathogenitätsinseln (Mc Carthy et al., 2011; Price et al., 2012; Uhlemann et al., 2012). Derartige LA-MRSA haben offenbar ein Pathogenitätspotenzial für den Menschen behalten (Witte et al., 2007; Fitzgerald, 2012). Von den bei Masttieren bisher bekannten LA-MRSA ist der klonale Komplex CC398 der am weitesten verbreitete.
Neben hohen Kolonisationsraten bei Masttieren werden MRSA auch bei Heim- und Hobbytieren in Tierkliniken als Besiedler und Infektionserreger nachgewiesen. Diese MRSA treten jedoch vielmehr endemisch auf und Transmissionsstudien deuten auf die wechselseitige Übertragung zwischen Mensch und Tier hin. Hierbei stehen dann eher human-assoziierte MRSA wie CC22, CC5, CC8 im Vordergrund und nach der tierärztlichen Intervention aufgetretene MRSA-Infektionen, insbesondere bei Heimtieren, müssen ganz klar als nosokomiales Infektionsgeschehen angesprochen werden (Strommenger et al., 2006; Cuny et al., 2008; Walther et al., 2009). Laut einer Studie des Institutes für Veterinärmikrobiologie der Freien Universität Berlin leben 89% der Hunde mit in der Wohnung des Tierbesitzers, 68,5% der Hunde sitzen auf dem Sofa, 53% lecken ihren Besitzern regelmäßig das Gesicht und 40% der Hunde dürfen mit im Bett schlafen (Walther et al., 2012a). Diese veränderten Verhaltensweisen mit engen räumlichen und körperlichen Kontakten zum Tier erhöhen die Wahrscheinlichkeit der wechselseitigen Übertragung multiresistenter Infektionserreger ohne Wirtsspezifität.
Seit ein paar Jahren wird verstärkt über MRSA des klonalen Komplexes CC130 berichtet, die anstelle des mecA-Gens das Homolog mecC besitzen. Diese MRSA haben ebenfalls eine wenig ausgeprägte Wirtsspezifität, wie durch die Nachweise bei Kühen, Schafen, Rehen, Pferden, Hunden, Katzen, Meerschweinchen sowie Menschen gezeigt werden konnte (Walther et al., 2012b). Aufgrund von Daten aus England und Dänemark liegt das ursprüngliche Reservoir bei Rindern (Garcia-Alvarez et al., 2011), was durch die Nachweishäufigkeit von 2% in Tankmilchproben in UK verdeutlicht wird (Paterson, 2013). Insbesondere der Anteil von 2,8% mecC positiver MRSA CC130 unter allen humanen MRSA in Dänemark 2011 weist auf die zoonotische Relevanz hin (Petersen et al., 2013)
nach oben
Vorkommen von LA-MRSA CC398 bei Masttieren
Nach dem ersten Bekanntwerden von LA-MRSA bei Schweinen in industriell geführten Mastanlagen in den Niederlanden im Jahr 2005 (Voss et al., 2005) folgten in kurzen zeitlichen Abständen weitere Berichte aus den Niederlanden, Dänemark, Deutschland sowie weiteren europäischen Ländern mit ausgeprägter industrieller Tiermast. Später wurde auch über das Auftreten in Nordamerika, wie in der Übersicht bei Pantosti (2012) ersichtlich, berichtet. Die Nachweise beschränkten sich zunächst auf Schweine, später kamen Mastrinder und Wirtschaftsgeflügel hinzu. Umfangreiche in Deutschland durchgeführte Studien in industriell geführten Mastanlagen zeigten, dass Schweine aller Altersstufen sowie Puten mit LA-MRSA CC398 asymptomatisch nasal kolonisiert sind (Tenhagen et al., 2009; Richter et al., 2012), wohingegen MRSA-Infektionen bei diesen Tieren weiterhin selten beschrieben werden (Tenhagen et al., 2009). Die Häufigkeit des Nachweises von LA-MRSA in Mastbetrieben korreliert positiv mit der Bestandsgröße (Alt et al., 2011; Graveland et al., 2011). Die Verbreitung von LA-MRSA zwischen den Mastbetrieben erfolgt primär über den Tierhandel, also das in Verkehr bringen von Ferkeln durch Zu- und Verkauf (Broens, 2011). Auf dem Weg zum Schlachthof kommt es zur Vermischung MRSA positiver und negativer Schlachtchargen und damit der Übertragung von MRSA auf anfänglich negative Tiere während des Transports sowie im Ruhebereich auf dem Schlachthof. Erwartungsgemäß und durch den Verarbeitungsprozess kaum zu verhindern, sind die Rohfleischprodukte dieser Tiere ebenfalls kontaminiert, wie eine Studie aus Deutschland bei 2,8% der Endprodukte von Schweinen nachwies (Beneke et al., 2011). Allerdings kommt es durch den Verarbeitungsprozess zu einer Keimreduzierung, so dass die Keimzahlen auf dem Lebendtier höher als auf dem Schlachtkörper sind. Dies gilt lediglich für Mastschweine und –rinder. (BfR 2010; Alt et al., 2011). Beim Wirtschaftsgeflügel verhält es sich umgekehrt. Bei Putenfleischproben, die im Jahr 2010 untersucht wurden, lag die Nachweishäufigkeit für LA-MRSA bei 32% (Vossenkuhl et al., 2014). In den Niederlanden lag die MRSA-Prävalenz in 2217 untersuchten Fleischproben bei 11,9% (de Boer et al., 2009) mit den höchsten Nachweisraten für Putenfleisch (35,3%) und Masthähnchen (16%). Vergleichbare Werte wurden aus Kanada und den USA berichtet (Weese et al., 2010; Pu et al., 2009), ebenso aus Taiwan (Lin et al., 2009). Diese Nachweise erfolgten nach Anreicherungskultur, weshalb von einer quantitativ geringgeradigen Kontamination der o.g. Fleischprodukte auszugehen ist. In einer im Jahr 2011 am Nationalen Referenzzentrum (NRZ) für Staphylokokken und Enterokokken durchgeführte Stichprobenuntersuchung am Auftauwasser von Masthähnchen konnte gezeigt werden, dass LA-MRSA CC398 im Auftauwasser von ~30% der untersuchten Proben in erheblicher Menge (100 – 1000 Kolonie-bildende Einheiten pro ml) ohne Anreicherung detektiert wurde (Cuny et al., 2011). Auch für Putenfleisch ist eine hohe Nachweisrate bekannt (Richter et al., 2012). Bisher sind bei den diesbezüglich untersuchten CC398-Isolaten keine Gene für die Expression von Enterotoxinen nachgewiesen worden, die für Lebensmittelvergiftungen verantwortlich sind. Tatsächlich sind auch keine LA-MRSA CC398 vermittelten Intoxikationen bekannt. Allerdings wurde auch über den Nachweis einer Enterotoxin-positiven Variante berichtet (Kadlec et al., 2009). Bei Schweinen aus alternativen Haltungsformen sind Nachweise mit LA-MRSA deutlich geringer oder nicht nachweisbar, wie eine Untersuchung in Betrieben bei Neuland e.V. zeigte (Cuny et al., 2012). Diese Tiere werden einerseits in einem geschlossenen System (kein Zukauf) und auf Stroh gehalten, die Tierzahlen sind mit 600 Mastplätzen deutlich geringer und diese Tiere werden zumeist im eigenen Betrieb geschlachtet. Eine Kontamination dieser Fleischprodukte durch Übertragung von LA-MRSA von Tieren aus industrieller Tiermast ist daher auszuschließen. In den Niederlanden durchgeführte Studien ergaben deutlich weniger MRSA-positive Schweinemastbetriebe bei einem Vergleich von „organic“ gegenüber konventionell (Van de Vijver et al., 2014). In „organischen“ Geflügelmastbetrieben wurden weder bei den Tieren noch bei den exponierten Menschen MRSA-Nachweise erbracht (Huibers et al., 2014). Vergleichende Studien zum Nachweis mehrfachresistenter bakterieller Infektionserreger auf Fleischprodukten von konventionell im Vergleich zu alternativ gehaltenen Tieren berücksichtigen diesen Punkt nur unzureichend (O`Brien et al., 2012).
Obgleich bei allen lebensmittelliefernden Tieren sowie deren Fleischprodukten MRSA-Nachweise erbracht wurden (keine Nachweise bei Schlachtequiden; Cuny, unveröffentlichte Daten), wird das Risiko einer Kolonisation oder Infektion durch Kontakt und Verzehr von Lebensmitteln tierischen Ursprungs für den Menschen bei Beachtung von Regeln guter Küchenhygiene durch die EFSA (EFSA, 2009) sowie durch das BfR (http://www.bfr.bund.de/cm/350/verbrauchertipps_schutz_vor_lebensmittelinfektionen_im_privathaushalt.pdf) als gering eingeschätzt. Nachdem eine in den Niederlanden durchgeführte Studie zeigte, dass der regelmäßige Verzehr von Mastgeflügel das nasale Kolonisationsrisiko erhöht (van Rijen et al., 2013), gehen wir momentan in einer 2016 gestarteten Studie an bisher 264 beprobten Mitarbeitern von Großküchen und Catering-Unternehmen der Frage nach, inwiefern der Kontakt zu Rohfleischprodukten im Zusammenhang mit der Zubereitung von Lebensmitteln die Besiedlungs- oder Infektionsrate mit LA-MRSA bei diesem Personenkreis beeinflusst (http://www.bfr.bund.de/de/presseinformation/2014/26/was_tun_mit_dem_huhn__mangelnde_kuechenhygiene_kann_krank_machen-191702.html)
nach oben
Vorkommen von LA-MRSA CC398 bei anderen Tieren
Auf die ansteigenden Kolonisations- und Infektionsraten mit MRSA bei verschiedenen Tierspezies wird in unterschiedlichen Studien hingewiesen. Bisher waren in Deutschland von den registrierten 855 Mio. Heim- und Nutztieren (Statistisches Bundesamt, 2012) vorwiegend die industriell gehaltenen Nutztieren asymptomatisch kolonisiert und zu 85% dem LA-MRSA CC398 zugeordnet. In der Studie von Vinzce et al., (2014) zeigt sich, dass bei 5.229 Wundabstrichen von Hunden, Katzen und Pferden in zunehmendem Maße auch LA-MRSA CC398 nachgewiesen wurden. LA-MRSA CC398 erlangt somit im Zusammenhang mit nosokomialen Infektionen bei Heim-und Hobbytieren auch als Infektionserreger bei Tieren eine zunehmende Bedeutung. Als Erreger postoperativer Wundinfektionen bei hospitalisierten Pferden wurden sie zunächst in Österreich und Belgien (Cuny et al., 2008; van den Eede et al., 2012), später dann in Deutschland nachgewiesen (Cuny et al., 2015). Die dabei detektierten Stämme sind in einer Reihe von Merkmalen verschieden zu den bei Masttieren verbreiteten LA-MRSA (Cuny et al., 2008) und repräsentieren offenbar einen inzwischen weltweit in Pferdeklinken verbreiteten Hospitalstamm, der einen Subklon (ST398; t011, SCCmec IV, GEN, clade C) darstellt (Abdelbary et al., 2014). Vanderhaeghen et al., (2010) berichten, dass bei ~10% der untersuchten Rinderfarmen in Belgien mit klinischer und subklinischer Mastitis LA-MRSA CC398 (t011; t567 und SCCmec IVa oder V) detektiert wurden. Auch in Deutschland stehen MRSA-Nachweise in der Tankmilch im Zusammenhang mit Euterbesiedlung/ subklinischer Mastitis bei Milchkühen (Kreausukon et al., 2012), wobei auch hier der Anteil für LA-MRSA CC398 zunimmt (unveröffentlichte Daten in Kooperation mit dem Diagnostiklabor Synlab, Augsburg (http://www.synlab.de/vet.phpg) sowie Daten aus dem BfR) Diesbezügliche weitere Berichte aus anderen europäischen Ländern zeigt die Übersicht bei Pantosti (2012).
nach oben
Übertragung von LA-MRSA CC398 auf den Menschen
Kontakt zu industriell gehaltenen landwirtschaftlichen Nutztieren:
Die Übertragung von Staphylokokken erfolgt primär über direkte Kontakte. Da in Ställen mit MRSA-positiven Schweinen auch der Stallstaub massiv kontaminiert ist (Schulz et al., 2012), kann eine Kolonisation beruflich exponierter Menschen ebenfalls über die Inhalation erregerhaltigen Stallstaubes erfolgen. Bei 77-86% der beruflich exponierten Landwirte, die in MRSA-positiven Anlagen tätig sind, liegt eine nasale Besiedlung mit LA-MRSA CC398 vor (Cuny et al., 2009; van Cleef et al., 2010a; Köck et al., 2012). Das Ausmaß der Besiedlung von exponierten Landwirten ist abhängig von der Dauer des Aufenthaltes in den Ställen und der Intensität der Tierkontakte (Graveland et al., 2011). Für einen nicht unbeträchtlichen Anteil kolonisierter Menschen bleibt diese Besiedlung auch nach zeitlicher Unterbrechung der Tätigkeit im Stall (z.B. Urlaub) bestehen (van Cleef et al., 2011a; Köck et al., 2012). Bei nicht unmittelbar exponierten Menschen, die auf dem gleichen Hof leben (Haushaltskontakte), ist dies nur zu 4 - 5 % der Fall. Unmittelbar exponierte Menschen, d.h. mit direktem Tierkontakt, haben ein 138-fach erhöhtes Risiko, eine MRSA-Besiedlung zu erwerben als nicht Exponierte im gleichen Umfeld. Eine Verbreitung über diesen Personenkreis hinausgehend ist bisher selten (Cuny et al., 2009). Auch für Arbeiter in Schlachtbetrieben wurden hohe Kolonisationsraten mit LA-MRSA CC398 nachgewiesen (van Cleef et al., 2010b; Mulders et al., 2010) und ebenfalls für Tierärzte mit Exposition zu landwirtschaftlichen Nutztieren (Paterson et al., 2013; Verkade et al., 2013). Eine in Deutschland dazu durchgeführte Studie ergab bei dieser Berufsgruppe eine Besiedlungsrate von 9%, sowie bei deren Familienangehörigen von 6% (Geinets et al., 2011; Hermes et al., 2012). Aus Belgien wurde über den Nachweis von LA-MRSA bei 7,5% der untersuchten Tierärzte berichtet, wesentlicher Risikofaktor war die Betreuung von Tiermastanlagen bzw. Nutztierkontakte (Garcia-Gaells et al., 2012). Eine im Zeitraum von 2008-2014 durchgeführte longitudinale Studie zur Dynamik des MRSA-Trägertums bei Veterinären und deren Haushaltskontakten zeigte, dass 4 der 31 (13%) viermal auf Ihren MRSA-Trägerstatus untersuchten Veterinäre permanent mit LA-MRSA CC398 kolonisiert waren. 21 der 185 (11%) untersuchten Familienangehörigen haben einen MRSA-Träger im Haushaltskontakt. Eine Kolonisation mit LA-MRSA CC398 kann dabei transient bis persistent sein. Der Kontakt zu einem MRSA-Träger im häuslichen Umfeld stellt einen Risikofaktor für den Erwerb einer MRSA-Kolonisation da (Walther et al., 2015).
Kontakt zu Pferden:
Die Nachweise von MRSA in Pferdekliniken deuten auf einen infektiösen Hospitalismus hin (Cuny et al., 2008; van den Eede et al., 2013). Bei aktuellen klinisch-epidemiologischen Untersuchungen im Bereich der Veterinärmedizin wurde eine vergleichsweise häufige nasale Kolonisation beim Veterinärpersonal festgestellt. Diese MRSA werden durch kolonisierte und/oder infizierte Pferde aber auch durch kolonisiertes Veterinärpersonal in die Pferdekliniken eingetragen und dort weiterverbreitet. Mehr als 90% der in diesen Tierkliniken aufgetretenen MRSA waren resistent gegen Gentamicin (GEN), ein Unterschied zu HA-MRSA aus Krankenhäusern sowie LA-MRSA aus der Community und der Tiermast. Wie die Genom-basierte weiterführende Analyse zeigte, bilden diese in Pferdekliniken verbreiteten MRSA (ST398, spa-Typ t011 oder t6867, SCCmec IV, GEN (canonical SNP 1748T) eine eigene, „pferdespezifische“ Subpopulation innerhalb von CC398 (Abd El-Bary et al., 2014), womit die Nutztierpopulation nicht das eigentliche Reservoir zu sein scheint. Eine von den Autoren in Kooperation mit dem Diagnostiklabor Dr. Böse GmbH durchgeführte Studie in Deutschland (Cuny et al., 2016a) bestätigt aktuelle Daten auf der Grundlage der Typisierung von 272 MRSA-Isolaten von hospitalisierten/ behandelten Pferden und 349 Abstrichen aus dem Nasenvorhof des Veterinärpersonal mit Kontakt zu diesen Pferden. Die Studie wurde im Zeitraum von 2011-2014 durchgeführt und umfasst Einsendungen verschiedenen Pferdekliniken und –praxen, wobei schwerpunktmäßig Bundesländer mit hoher Nutztierdichte vertreten waren. Im Durchschnitt betrug die MRSA-Prävalenz beim Veterinärpersonal 18,8%. Diese Besiedlungshäufigkeit ist hoch im Vergleich zu Tierärzten insgesamt mit ~9% (Walter et al., 2016) und zu Pflegepersonal und Ärzten in Krankenhäusern mit ~2% (Kramer et al., 2009). Der Erwerb einer nasalen Kolonisation erfolgt in Tierkliniken ebenso wie in Krankenhäusern primär durch die Hände, deren Kontamination direkt von der Tätigkeit am Patienten ausgehen kann oder indirekt über kontaminierte Instrumente und Gebrauchsgegenstände sowie kontaminierte Oberflächen der Patientenumgebung erfolgt. Die hohe Besiedlungsrate mit MRSA bei beruflich exponierten Menschen in Tierkliniken ist damit ein Hinweis auf die Notwendigkeit der strikten Einhaltung der Basishygiene. Infektionen mit S.aureus/ MRSA beim Menschen gehen oft von der eigenen nasalen Besiedlung aus oder werden nosokomial erworben. Basierend auf diesen Daten stellt sich die Frage nach dem Ausmaß von MRSA-Nachweisen bei Personen mit Kontakt zu diesen Tieren, wie z.B. Reitern. Insbesondere auch deshalb, weil diese Personengruppe mit dem Pferdesport eine der 5-verletzungsreichsten Sportarten betreiben. Die Anfang 2015 begonnenen Untersuchungen an Reiter-Pferde-Paaren werden fortgesetzt. Bisher gibt es keine MRSA-Nachweise bei den diesbezüglich untersuchten gesunden Sport- sowie Zuchtpferden oder Schlachtequiden und deren Kontaktpersonen.
Kontakt zu Geflügel:
Infolge des nahezu ausgeschlossenen Zuganges zu Geflügelmastbetrieben für diesbezügliche Untersuchungen in Deutschland gibt es bisher auch keine eigenen Daten. In den Niederlanden war offenbar eine begrenzte Studie möglich, die für Menschen mit Tätigkeit in Geflügelmastanlagen eine häufige MRSA- Besiedlung fand (67%; statistisch nicht gesichert; Geenen et al., 2013).
Indirekte Kontakte:
Eine über Mastanlagen und deren Wohnumfeld hinausgehende Verbreitung innerhalb der Bevölkerung im ländlichen Umfeld erfolgt offenbar selten, wie unsere Untersuchung an Schülern einer Zentralschule sowie Bewohnern zweier Alten-und Pflegeheime zeigte (Cuny et al., 2009). Diese in einer Region mit hoher Dichte an Schweinemastanlagen durchgeführte Untersuchung ergab vier Nachweise von LA-MRSA CC398, die in direktem Zusammenhang mit Tierkontakten bzw. der Mitarbeit in Schweinemastanlagen standen. MRSA gelangen über Entlüftungsanlagen von Mastbetrieben nach außen und wurden in Windrichtung gemessen in einem Abstand von 350m in der Abluft nachgewiesen und auf dem Boden in einer Entfernung von 500m zum Stall detektiert (Schulz et al., 2012). Friese et al. (2013) haben LA-MRSA CC398 in der Gülle und in Böden, auf denen die Gülle von Geflügelmastanlagen ausgebracht wurde, nachgewiesen. In diesem Zusammenhang scheint auch der Nachweis von LA-MRSA in Kotproben von Saatkrähen in Österreich von großem Interesse zu sein (Loncaric et al., 2013). Wie eine Untersuchung von Bisdorff et al. (2012) in Niedersachsen zeigte, wurden LA-MRSA CC398 in Einzelfällen bei Menschen ohne Nutztierkontakte, jedoch mit Wohnsitz in Nachbarschaft zu Mastanlagen, nachgewiesen (1%). Weitere Untersuchungen werden klären müssen, ob dies ursächlich mit der Emission aus derartigen Anlagen im Zusammenhang steht. In europäischen und eigenen Studien nimmt der Anteil an Patienten mit Nachweis von LA-MRSA CC398 zu, die anamnestisch jedoch keine Kontakte zum Livestock aufweisen (Benito et al., 2014; Deiters et al., 2014). Vor diesem Hintergrund muss kritisch die Frage nach weiteren Quellen für den Erwerb von LA-MRSA unabhängig von Kontakten zum Livestock geklärt werden.
Bisher war davon auszugehen, dass Übertragungen von LA-MRSA CC398 von Mensch zu Mensch eher selten erfolgen. Aktuelle Daten aus dem Aufnahme-Screening in Rehabilitationskliniken im Nordwesten Deutschlands ergaben für eine MRSA-Gesamtprävalenz von 1,2% einen Anteil von 0,24% für LA-MRSA CC398 (21% von allen MRSA-Nachweisen). Dabei gaben 38% der betroffenen Patienten mit LA-MRSA CC398 –Trägerstatus an, keinen direkten Kontakt zu Schweinen zu haben, und 75% hatten laut Befragung keine Exposition gegenüber Rindern (Köck et al., 2011). Nationale Surveillancedaten aus den Niederlanden zeigen, dass sich für 20% der Personen mit LA-MRSA-Nachweis keine Tierkontakte nachweisen ließen (Lekkerkerk et al., 2012). Die Befragung von Patienten mit Infektionen und Nachweis von LA-MRSA-CC398, die in einem Klinikum in Portugal behandelt wurden, ergab für fast die Hälfte von ihnen keine Kontakte zu landwirtschaftlich Nutztieren oder Haustieren (Torres et al., 2014). In den Niederlanden konnten Feingold et al., (2012) zeigen, dass Bewohner von Regionen mit hoher Nutztierhaltungsdichte, unabhängig von deren eigenen Tierkontakten, signifikant häufigere Kolonisationsraten mit LA-MRSA CC398 aufwiesen. Zudem zeigen zwei 2012 durchgeführte Untersuchungen unter Patienten niederländischer Krankenhäuser, dass unter den dort behandelten Patienten mit LA-MRSA-Nachweis 15% bis 70% keine anamnestischen Angaben zu Nutztierkontakten machen konnten. In einer in der Region Münsterland durchgeführten Fall-Kontroll-Studie bestätigen sich dieser Tendenzen: hier gaben 62% der in einem Universitätsklinikum behandelten und mit LA-MRSA CC398 kolonisierten Patienten an, beruflich bedingten direkten Kontakt zu Schweinen zu haben, weitere 19% hatten Kontakt zu Rindern rund 19% zu Pferden, wie bei Köck et al., (2009) nachzulesen ist. Allerdings konnte in dieser retrospektiven Untersuchung bei 31% der Patienten mit CC398-Nachweis kein Kontakt zu landwirtschaftlichen Nutztieren erhoben werden.
Von den im Zeitraum 2013 -2015 im NRZ für Staphylokokken und Enterokokken typisierten MRSA-Isolaten lag der Anteil unter allen MRSA-Klonen für LA-MRSA CC398 bei 26%. Bis auf einen betroffenen Patienten gab es in der anamnestischen Aufarbeitung keine Exposition zur Tiermast. Unter den untersuchten Isolaten gab es lediglich einen Nachweis auf Vorhandensein des Immun-Evasions-Genclusters. Dies deutet darauf hin, dass diese Isolate nicht mit einer Etablierung von LA-MRSA CC398 als nasaler Besiedler bei Menschen, unabhängig von Nutztierkontakten, in Verbindung stehen.
nach oben
Infektionen beim Menschen
LA-MRSA sind als asymptomatische Besiedler bei Menschen mit direktem Tierkontakt weit verbreitet. Sie besitzen eine grundsätzliche Pathopotenz wie S. aureus und können die gleichen vielgestaltigen Krankheitsbilder verursachen (Witte et al., 2007). Außerhalb der Krankenhäuser sind es überwiegend tiefgehende Haut-Weichgewebeinfektionen, die einer chirurgischen Behandlung bedürfen (van Cleef et al., 2011, b) und betreffen vorwiegend Personen mit direkter beruflicher Exposition, gelegentlich deren Familienangehörige. Als MRSA aus tiefgehenden Haut-Weichgewebeinfektionen, die außerhalb von Krankenhäusern auftreten, nehmen LA-MRSA dabei einen Anteil von 10 -15% ein (Cuny und Layer, 2011, Layer et al., 2013). Bisher sind diese Infektionen nicht häufig.
LA-MRSA können jedoch durch kolonisierte Personen in stationäre Pflegeeinrichtungen eingetragen werden und ausgehend von der asymptomatischen Besiedlung nosokomiale Infektionen verursachen, wie tiefgehende Wundinfektionen nach Hüftgelenkersatz, Lungenentzündung bei künstlich beatmeten Patienten oder Sepsis (Witte et al., 2007). Bei einer Netzwerk-Studie im Süden Brandenburgs, in die 13.855 Patienten inkludiert waren, lag die Nachweishäufigkeit für LA-MRSA CC398 im Rahmen dieses prästationären Eingangsscreenings bei 0,08% (Juretzek et al., 2011). In der Ems-Dollart Region in Nordrhein-Westfalen hingegen, mit einer sehr hohen Dichte an industriellen Schweinemastanlagen, stieg der Anteil von LA-MRSA CC398 unter allen bei Aufnahmescreening erfassten MRSA (bei 1,6% der Patienten) von 14% im Jahr 2008 auf 23% im Jahr 2011 (Köck et al., 2013). Dem entsprach auch der Anstieg des Anteils von allen aus oberflächlichen Wundinfektionen detektierten LA-MRSA von 7% auf 10% im gleichen Untersuchungszeitraum. Für MRSA-Nachweise aus klinischen Materialien im gleichen Zeitraum lag der Anteil für LA-MRSA sogar bei 8% für Blutkultur-Isolate, 11% aus tiefgehenden Wundabstrichen und 14% aus tiefen respiratorischen Sekreten (Köck et al., 2011, Köck et al., 2013). Für Deutschland insgesamt gesehen lag der Anteil von LA-MRSA CC398 an allen untersuchten MRSA aus nosokomialen Infektionen bei 2,4% (Layer et al., 2012). In einer Stichprobe von MRSA-Isolaten aus Blutkulturen aus dem gesamten Bundesgebiet lag der Anteil von LA-MRSA bei 1,7 % (Stichprobe unter 467 MRSA aus Blutkulturen als Einsendungen an das Nationale Referenzzentrum für Staphylokokken und Enterokokken für 2011). Die Ausbreitung im Krankenhaus (Mensch-Mensch; Mensch-Umgebung-Mensch) erfolgt im Unterschied zu den HA-MRSA bisher nur selten (Wassenberg et al., 2011). Dass jedoch auch eine Ausbreitung in kurativen Einrichtungen möglich ist, zeigt ein Cluster in einem Krankenhaus in den Niederlanden (4 behandelte Patienten mit Besiedlung zeitgleich mit einem Nachweis eines infizierten Ulcus cruris) sowie zwischen Altenheimbewohnern in einem Pflegeheim (Wulff et al., 2008).

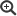 Klonale Linien (ST) und klonale Komplexe (CC) von S. aureus bei Menschen und Tieren
Quelle: Cuny et al., 2010, Fitzgerald, 2012, Pantosti, 2012; * Einzelnachweise (Cuny und Witte, 2011/2012, unveröffentlicht)
Klonale Linien (ST) und klonale Komplexe (CC) von S. aureus bei Menschen und Tieren
Quelle: Cuny et al., 2010, Fitzgerald, 2012, Pantosti, 2012; * Einzelnachweise (Cuny und Witte, 2011/2012, unveröffentlicht)
Klonale Linien (ST) und klonale Komplexe (CC) von
S. aureus bei Menschen und Tieren Quelle: Cuny et al., 2010, Fitzgerald, 2012, Pantosti, 2012; * Einzelnachweise (Cuny und Witte, 2011/2012, unveröffentlicht)
nach oben
Risikoeinschätzung für den Menschen
Nach bisheriger Datenlage (Stand 2016 ) sind LA-MRSA (CC398) als ein potenzielles Risiko für Infektionen des Menschen, insbesondere mit direkter Exposition zur industriellen Tiermast, einzuschätzen. Erste Beobachtungen, die auf eine Verbreitung von Mensch zu Mensch in der Bevölkerung hindeuten, bedürfen erhöhter Aufmerksamkeit. Als Infektionserreger sind sie nicht weniger virulent als andere MRSA, unterscheiden sich jedoch von HA-MRSA in ihrem epidemischen Auftreten hinsichtlich der Verbreitung in Einrichtungen des Gesundheitswesens. Die Ausbreitung im Krankenhaus selbst (Mensch → Mensch, Mensch → Umgebung → Mensch) erfolgt im Unterschied zu den HA-MRSA bisher nur selten. Eine niederländische Studie kam zu dem Ergebnis, dass LA-MRSA CC398 im Vergleich zu klassischen Krankenhaus-assoziierten (HA-) MRSA-Klonen eine 5,9-fach geringere Transmissionswahrscheinlichkeit in Krankenhäusern aufwiesen (Wassenberg et al., 2011). Mögliche Gründe könnten sein, dass die Nachweisraten für LA-MRSA häufig aus der bereits bei Aufnahme in Krankenhäusern bestehenden Besiedlung stammt. Weiterhin weisen die von LA-MRSA betroffenen Patienten selten prädisponierende Vorerkrankungen auf oder bedürfen einer intensiv-stationären Betreuung, womit die Behandlungs-assoziierten Kontakte geringer sind.
Es gilt als erwiesen, dass sich LA-MRSA CC398 aus Methicillin-empfindlichen S. aureus (MSSA) als Vorläufer, mit Herkunft beim Menschen, entwickelt haben. Bei der Wirts-Adaptation an Tiere haben sie mobile genetische Elemente als Teil ihres Genoms verloren und wiederum andere erworben (Fitzgerald, 2012). Ein derartiger Gen-Austausch ist in beide Richtungen vorstellbar, womit LA-MRSA aufgrund ihrer sehr weiten Verbreitung bei Tieren zu einer gesundheitlichen Bedrohung für den Menschen avancieren können. Bestimmte MSSA des klonalen Komplexes CC398, die zur Methicillin-empfindlichen „Vorläufer-Population“ gehören und den spa-Typ t571 zeigen, haben offensichtlich ein hohes pathogenes Potential im Hinblick auf Sepsis und tiefgehende Wundinfektionen. (Beobachtungen in den USA; Uhlemann et al., 2012) und traten auch in Frankreich und Belgien auf. In Deutschland sind sie noch selten (Cuny et al., 2013). MSSA CC398 können durch Aufnahme eines Prophagen die Fähigkeit zur Bildung von Panton-Valentin-Leukozidin (lukPV) erwerben und damit verstärkt tiefgehende Haut-Weichgewebeinfektionen verursachen. Derartige Isolate sind in China verbreitet (Zhao et al., 2012), traten jedoch auch schon vereinzelt in Deutschland auf. Die bisher in Deutschland nachgewiesenen MSSA und MRSA von Typ CC389 mit lukPV gehören zur „Vorläufer-Population“ und stehen nicht im Zusammenhang mit Tieren (Cuny et al., 2015). Einen deutlichen Hinweis auf die „Anpassung“ von LA-MRSA CC398 an den Menschen ist der Wiedererwerb des Immun-Evasions-Gen-Clusters (IEC). IEC ist typisch für S. aureus-Stämme vom Menschen (98%) und als Bestandteil von Prophagen gut übertragbar. Das Vorhandensein von IEC stellt keine Voraussetzung für die Pathopotenz dar, ist aber wahrscheinlich für eine permanente nasale Besiedlung beim Menschen verantwortlich. MSSA CC398 haben IEC auf dem Weg zum Tier, wo sie die Methicillinresistenz erwarben und zum LA-MRSA CC398 wurde, verloren. Der Wiedererwerb von IEC (Nachweise bei ~10% der „pferdespezifischen Subpopulation-CC398“ mit 61 positiven Isolaten von Pferden und 47 von Tierärzten) infolge des Kontaktes mit S. aureus-Stämmen vom Menschen (wechselseitige Transmission Mensch-Tier) ist Ausdruck der Readaptation an den Menschen (Cuny et al., 2016a).Wir fanden IEC auch bei ~20% der Isolate aus Infektionen beim Menschen, die der Livestock-assoziierten Subpopulation zugeordnet wurden (Cuny et al., 2015a).
Wenn bisher noch selten nachgewiesen, erfordert das Auftreten der zwischen Staphylokokken übertragbaren Resistenz gegen Linezolid, einem Antibiotikum, das der Behandlung von schweren MRSA-Infektionen vorbehalten sein sollte, besondere Aufmerksamkeit Das Auftreten der Linezolid-Resistenz wurde erstmalig in Koagulase-negativen Staphylokokken (KNS) von Masttieren beobachtet. Inzwischen wurden derartige Isolate aus der nasalen Besiedlung eines Landwirtes sowie bei Tierärzten und deren Familienangehörigen detektiert (Cuny et al., 2016b). Diese vom cfr -Gen vermittelte Resistenz beruht auf Di-Methylierung der 23S rRNA in der Position A2503 und ist bei Staphylokokken von Tieren schon seit längerem bekannt (Kehrenberg et al., 2005). Die Veränderung am Peptidyltransferase-Zentrum der großen ribosomalen Untereinheit führt zum sogenannten PhLOPS–Phänotyp mit Resistenz gegenüber Phenicolen, Lincosamiden, Oxazolidinonen, Pleuromutilinen und Streptogramin A. Bereits 2008 wurde ein LA-MRSA CC398 mit übertragbarer Linezolid-Resistenz bei einem Schwein gefunden (Kehrenberg et al., 2009) und im Sommer 2010 bei einem Schweinemäster aus dem Nürnberger Raum im Zusammenhang mit einer schweren Beatmungspneumonie nachgewiesen (Cuny et al., 2016b). Aus einem Krankenhaus in Madrid wurde über das gehäufte Auftreten von Infektionen mit einem Linezolid-resistenten HA-MRSA berichtet (Sanchez-Garcia et al., 2010).
nach oben
Präventionsmaßnahmen
Basierend auf Ergebnissen von Prävalenzstudien sowie aufgrund der insgesamt geschilderten Datenlage erfolgte eine Erweiterung der Empfehlung für ein Screening auf nasale Besiedlung mit MRSA bei Risikopatienten um den Personenkreis mit direkten beruflichen Kontakten zu landwirtschaftlichen Nutztieren (KRINKO/RKI, 2008). Hinsichtlich des umsichtigen Umgangs mit rohem (Geflügel-)Fleisch wird auf die Empfehlungen des Bundesinstituts für Risikobewertung (BfR) hingewiesen ("Fragen und Antworten zu Methicillin-resistenten Staphylococcus aureus (MRSA)", Link siehe unten).
nach oben
Bedeutung für die Praxis
LA-MRSA CC398 erweisen sich in Regionen mit einer hohen Dichte an Schweinemastanlagen zunehmend als ein wichtiger Erreger von Infektionen (Köck et al., 2013, Van Alen et al., 2016). Der Nachweis im Zusammenhang mit tiefgehenden Haut-Weichgewebeinfektionen, die außerhalb von Krankenhäusern erworben wurden, unterstreicht die Notwendigkeit der mikrobiologischen Diagnostik in diesen Fällen.
nach oben
Weitere Forschung
Es besteht die Notwendigkeit, durch molekulare Typisierung und weitere Genom-basierte Analyse Isolate im Rahmen interdisziplinär angelegter Studien genau zu charakterisieren, um rechtzeitig erkennen zu können, ob eine weitere Anpassung an den Menschen und die Aufnahme weiterer Virulenz-assoziierter Gene erfolgen. Der vom BMBF geförderte interdisziplinär angelegte Forschungsverbund „MedVet-Staph“ bearbeitet das Auftreten und die Verbreitung von S. aureus im Allgemeinen und von MRSA als Zoonose-Erreger im Besonderen sowie die damit im Zusammenhang stehenden Erreger-Eigenschaften. Der Schwerpunkt liegt dabei auf der wechselseitigen Übertragung zoonotischer S. aureus-/MRSA-Stämme zwischen Mensch und Tier im Sinne des „One World-One Health“ Ansatzes. Verschiedene Konsortien innerhalb dieses Forschungsverbundes (Förderperiode: 2010-2016) untersuchen die Erregereigenschaften bezüglich der Virulenz, Pathogenität, Antibiotikaresistenz und Wirts-Zell-Interaktion, aber ebenso die Mechanismen ihrer Übertragung. In Verbindung damit werden die evolutionären Veränderungen dieser Erreger erfasst, die auch Aussagen hinsichtlich des zoonotischen Potenzials von S. aureus/ MRSA, bezüglich der gesundheitlichen Auswirkungen von Mensch und Tier, ermöglichen. Aufgrund der Untersuchung von Mechanismen zur Verbreitung von S. aureus/ MRSA werden Maßnahmen zur Vermeidung der Weiterverbreitung dieser Erreger erarbeitet, damit zielgerichtet das Eintragsrisiko über die Lebensmittelkette sowie innerhalb der Einrichtungen des Gesundheitswesens unterbunden werden kann. Primäres Ziel dieses Forschungsverbundes ist ein Erkenntnisgewinn, der unmittelbar der Entwicklung rationaler und evidenzbasierter Empfehlungen für Surveillance und Prävention von Erregern mit zoonotischem Potential dient, einschließlich der sich daraus ableitenden weiterführenden diagnostischen Maßnahmen und Methoden. Viele der in dieser Übersicht vorgestellten Daten sind aus diesem Forschungsverbund hervorgegangen (Köck et al., 2014). Dies betrifft vor allem die Studienergebnisse zur weite Verbreitung von LA-MRSA CC398 bei industriell gehaltenen Tieren, die zunehmenden Nachweise aus Infektionen in Tierkliniken sowie die Übertragung auf den Menschen und hier die Einschätzung als Infektionserreger. Wichtig sind dabei die Beobachtungen, dass der Anteil von LA-MRSA CC398 an allen MRSA-Infektionen beim Menschen (Wundinfektionen, Pneumonie, Sepsis) in Deutschland allgemein bei ~2% liegt, in Gegenden mit einer hohen Dichte von Tiermastanlagen jedoch auf bis zu 10% anstieg. In bis zu 38% der Fälle können keine direkten Tierkontakte nachgewiesen werden, weshalb auch andere Übertragungswege wahrscheinlich sind. Das gehäufte Auftreten von MRSA in Tierkliniken und die Häufigkeit der nasalen Kolonisation mit MRSA bei Tierärzten erfordern dort effektivere Präventionsmaßnahmen. Gerade die Daten aus den Tierkliniken unterstreichen die Notwendigkeit des „One-Halth“- Ansatzes zur Klärung dieser Problematik. Weiterhin erfolgten eine umfangreiche Analyse des Reservoirs an Antibiotika-Resistenzgenen bei Staphylokokken von Tieren und wie am Beispiel der übertragbaren Linezolid-Resistenz (plasmidlokalisiertes cfr-Gen), auch Studien zur möglichen Übertragung zwischen Tieren und Menschen. Auch hier ist der „One Health“ - Ansatz gefordert. Im Rahmen des Forschungsverbundes wurden PCR- basierte Methoden für die schnelle Unterscheidung von Subpopulationen innerhalb des klonalen Komplexes CC398 sowie zur Identifizierung der Homologe des mec-Gens etabliert.
nach oben
Literatur
- Abdelbary MM, Wittenberg A, Cuny C, Layer F, Kurt K, Wieler LH, Walther B, Skov R, Larsen J, Hasman H, Fitzgerald JR, Smith TC, Wagenaar JA, Pantosti A, Hallin M, Struelens MJ, Edwards G, Böse R, Nübel U, Witte W. (2014): Phylogenetic analysis of Staphylococcus aureus CC398 reveals a sub‐lineage epidemiologically associated with infections in horses. PLoS One. 9(2):e88083.
- Alt, K., Fetsch, A., Schroeter, A., Guerra, B., Hammerl, J.A.,Hertwig, S., Senkov, N.,Geinets,a., Mueller-Graf, C., Braeunig, J., Kaesbohrer, A., Appel, B., Hensel, A., Tenhagen, BA. (2011): Factors associated with the occurrence of MRSA CC398 in herds of fattening pigs in Germany. BMC Veterinary Research 7: 69
- Alt, K., Fetsch, A., Schroeter, A., Guerra, B., Hammerl, J.A.,Hertwig, S., Senkov, N., Beneke, B., Klees, S., Stührenberg, B., Fetsch, A., Kraushaar, B., Tenhagen, BA., (2011): Prevalence of methicillin-resistant Staphylococcus aureus in a fresh meat pork production chain. J Food Prot. 74(1):126-9.
- Becker K, Ballhausen B, Kahl BC, Köck R. (2015): The clinical impact of livestock-associated methicillin-resistant Staphylococcus aureus of the clonal complex 398 for humans. Vet Microbiol. S0378-1135(15)30082-1.
- Beneke, B., Klees, S., Stührenberg, B., Fetsch, A., Kraushaar, B., Tenhagen, BA. (2011): Prevalence of methicillin-resistant Staphylococcus aureus in a fresh meat pork production chain. Journal of Food Protection. 74 (1):126-129.
- Benito, D., Lozano, C., Rezusta, A., Ferrer, I., Vasquez, M.A., Ceballos, S., Zarazaga, M., Revillo, M.J., Torres, C. (2014). Characterization of tetracycline and methicillin resistant Staphylococcus aureus strains in a Spanish hospital: Is livestock-contact a risk factor in infections caused by MRSA CC398? Int. J. Med. Microbiol. 304, 1226–1232.
- Bisdorff, B., Scholhölter, J.L., Claußen, K., Pulz, M., Nowak, D., Radon, K., (2012): MRSA ST398 in livestock farmers and neighbouring residents in a rural area in Germany Epidemiol. Infect. 140, 1800–1808.
- Broens, EM. (2011): MRSA CC398 in the pig production chain. Prev Vet Med. 98(2-3):182-9.
- Cuny C, Strommenger B, Witte W, Stanek C (2008): Clusters of infections in horses with MRSA ST1, ST254, and ST398 in a veterinary hospital. Cuny C, Strommenger B, Witte W, Stanek C. Microb Drug Resist.14(4):307-10
- Cuny, C., Nathaus, R., Layer, F., Strommenger, B., Altmann, D., Witte, W., (2009): Nasal colonization of humans with methicillin-resistant Staphylococcus aureus (MRSA) CC398 with and without exposure to pigs. PLoS One.4(8):e6800.
- Cuny, C., Friedrich, A., Kozytska, S., Layer, F., Nubel, U., Ohlsen, K., Strommenger, B., Walther, B., Wieler, L., and Witte, W., (2010): Emergence of methicillin-resistant Staphylococcus aureus (MRSA) in different animal species. Int. J. Med. Microbiol. 300, 109–117.
- Cuny C, Layer F. (2011): MRSA-Situation in Deutschland 2010. Epidemiologisches Bulletin 26/2011
- Cuny, C., Layer, F., Witte, W., (2011a): Staphylococcus aureus and MRSA in thawing liquid of broiler chicken cacasses and their relation to clonal lineages from humans. Abstract ZOV01, Intern J Med Microbiol.301S1:117
- Cuny, C., Layer, F., Strommenger, B., Witte, W., (2011b): Rare occurrence of methicillin-resistant Staphylococcus aureus CC130 with a novel mecA homologue in humans in Germany. PLoS One. 6.
- Cuny, C., Friedrich, AW., Witte, W., (2012): Absence of LA-MRSA CC398 as nasal colonizer of pigs raised in an alternative system. Appl Environ Microbiol. 78(4): 1296-7.
- Cuny C, Layer F, Köck R, Werner G, Witte W.(2013): Methicillin susceptible Staphylococcus aureus (MSSA) of clonal complex CC398, t571 from infections in humans are still rare in Germany. PLoS One. 8(12):e83165.
- Cuny C, Abdelbary M, Layer F, Werner G, Witte W. (2015a) Prevalence of the immune evasion gene cluster in Staphylococcus aureus CC398. Vet Microbiol; 177(1-2):219-23.
- Cuny C, Layer F, Werner G, Harmsen D, Daniels-Haardt I, Jurke A, Mellmann A, Witte W, Köck R. (2015b) State-wide surveillance of antibiotic resistance patterns and spa types of methicillin-resistant Staphylococcus aureus from blood cultures in North Rhine-Westphalia, 2011-2013. Clin Microbiol Infect; 21(8):750-7.
- Cuny C, Wieler LH, Witte W. (2015c): Livestock-Associated MRSA: The Impact on Humans .Antibiotics 4(4):521-43.
- Cuny C, Abdelbary M, Köck R, Layer F, Scheidemann W, Werner G, Witte, W. (2016a): Methicillin-resistant Staphylococcus aureus from infections in horses in Germany are frequent colonizers of veterinarians but rare among MRSA from infections in humans. One Health 2:11–7.
- Cuny C, Böse R, Scheidemann W, Witte (2015): Auftreten und Verbreitung von Methicillin-resistenten Staphylococcus aureus in Pferdekliniken. Pferdespiegel 18(04): 152-8.
- Cuny C, Arnold P, Hermes J, Eckmanns T, Mehraj J, Schoenfelder S, Ziebuhr W, Zhao Q, Wang Y, Feßler At, Krause G, Schwarz S, Witte W (2016b): Occurrence of cfr-mediated multiresistance in staphylococci from veal calves and pigs, from humans at the corresponding farms, and from veterinarians and their family members. Vet Microbiol, http://dx.doi.org/10.1016/j.vetmic.2016.04.002
- De Boer, E., Zwartkruis-Nahuis, J.T., Wit, B., Huijsdens, X.W., deNeeling, A.J., Bosch, T., vanOosterom, R.A., Vila, A., and Heuvelink, A.E., (2009): Prevalence of methicillin-resistant Staphylococcus aureus in meat. Int. J. Food Microbiol. 134, 52–56.
- Deiters, C., Günnewig, V., Friedrich, A.W., Mellmann, A., Köck, R., (2015): Are cases of Methicillin-resistant Staphylococcus aureus clonal complex (CC) 398 among humans still livestock-associated? Int J Med Microbiol. 305, 110-113.
- Deurenberg RH, Stobberingh EE. (2009): The molecular evolution of hospital- and community-associated methicillin-resistant Staphylococcus aureus. Curr Mol Med. 9(2):100-15.
- European Antibiotica Resistance Surveillance System (EARSS) 2010
- European Food Safety Authority (EFSA) (2009): Analysis of the baseline survey on the prevalence of methicillin-resistant Staphylococcus aureus (MRSA) in holdings with breeding pigs in the EU, Part A: MRSA prevalence estimates. Eur. Food Saf. Auth. doi:10.2903/j.efsa.2009.1376.
- Fitzgerald, JR., (2012): Livestock-associated Staphylococcus aureus: origin, evolution and public health threat Trends Microbiol.20 (4):192-8.
- Friese A, Schulz J, Laube H, von Salviati C, Hartung J, Roesler U.(2013): Faecal occurrence and emissions of livestock-associated methicillin-resistant Staphylococcus aureus (laMRSA) and ESbl/AmpC-producing E. coli from animal farms in Germany. Berl Munch Tierarztl Wochenschr. 126(3-4).
- García-Álvarez L, Holden MT, Lindsay H, Webb CR, Brown DF, Curran MD, Walpole E, Brooks K, Pickard DJ, Teale C, Parkhill J, Bentley SD, Edwards GF, Girvan EK, Kearns AM, Pichon B, Hill RL, Larsen AR, Skov RL, Peacock SJ, Maskell DJ, Holmes MA (2011): Methicillin-resistant Staphylococcus aureus with a novel mecA homologue in human and bovine populations in the UK and Denmark: a descriptive study. Lancet Infect Dis. 11(8):595-603.
- Garcia-Graells, C., Antoine, J., Larsen, J., Catry, B., Skov, R., Denis, O., (2012): Livestock veterinarians at high risk of acquiring methicillin-resistant Staphylococcus aureus ST398. Epidemiol. Infect. 140(3), 383–9.
- Geenen PL, Graat EA, Haenen A, Hengeveld PD, Van Hoek AH, Huijsdens XW, Kappert CC, Lammers GA, Van Duijkeren E, Van De Giessen AW.(2013): Prevalence of livestock-associated MRSA on Dutch broiler farms and in people living and/or working on these farms. Epidemiol Infect. 141(5):1099-108.
- Geinets, A., Mueller-Graf, C., Braeunig, J., Kaesbohrer, A., Appel, B., Hensel, A., and Graveland, H., Wagenaar, J.A., Bergs, K., Heesterbeek, H., Heederik, D., (2011): Persistence of livestock associated MRSA CC398 in humans is dependent on intensity of animal contact. PLoS One.6(2),e16830.
- Hermes, J., Witte, W., Cuny, C., Kleinkauf, N., Jansen, A., Eckmanns, T., (2012): Prevalence of MRSA nasal colonization over times in veterinarians and their household contacts in Germany. Intern. J. Med. Microbiol. 302 S1, Abstract Z0V01.
- Huijbers PM, van Hoek AH, Graat EA, Haenen AP, Florijn A, Hengeveld PD, van Duijkeren E. (2015): Methicillin-resistant Staphylococcus aureus and extended-spectrum and AmpC β-lactamase-producing Escherichia coli in broilers and in people living and/or working on organic broiler farms. Vet Microbiol. 176(1-2):120-5.
- Ito, T., Hiramatsu, K., Tomasz, A., de Lencastre, H., Perreten, V., Holden, M.T., Coleman, D.C., Goering, R., Giffard, P.M., Skov, R.L., Zhang, K., Westh, H., O'Brien, F., Tenover, F.C., Oliveira, D.C., Boyle-Vavra, S., Laurent, F., Kearns, A.M., Kreiswirth, B., Ko, K.S., Grundmann, H., Sollid, J.E., John, J.F. Jr., Daum, R., Soderquist, B., Buist, G.; (2012): International Working Group on the Classification of Staphylococcal Cassette Chromosome Elements (IWG-SCC). Guidelines for reporting novel mecA gene homologues. Antimicrob. Agents Chemother. 56(10),4997–9.its relevance to human health. Front Microbiol. 3,127.
- Juretzek, M., Armengol Porta, A., Bühling, R., Haubold, M., Pohle, F., Schwab, W., Bär. (2011): Epidemiology of methicillin-resistant Staphylococcus aureus at hospital admission in South Brandenburg, Germany. Abstract PV1, Annual Meeting DGHM 2011.
- Kadlec, K., Ehricht, R., Monecke, S., Steinacker, U., Kaspar, H., Mankertz, J., Schwarz, S., (2009): Diversity of antimicrobial resistance pheno- and genotypes of methicillin-resistant Staphylococcus aureus ST398 from diseased swine. J Antimicrob Chemother. 64(6):1156-64.
- Kehrenberg, C., Cuny, C., Strommenger, B., Schwarz, S., Witte, W., (2009): Methicillin-resistant and -susceptible Staphylococcus aureus strains of clonal lineages ST398 and ST9 from swine carry the multidrug resistance gene cfr. Antimicrob Agents Chemother. 53(2):779-81.
- Kehrenberg, C., Schwarz, S., Jacobsen, L., Hansen, LH., Vester, B., (2005): A new mechanism for chloramphenicol, florfenicol and clindamycin resistance: methylation of 23S ribosomal RNA at A2503. Mol Microbiol.57(4):1064-73.
- Köck, R., Brakensiek, L., Mellmann, A., Kipp, F., Henderikx, M., Harmsen, D., Daniels-Haardt, I., von Eiff, C., Becker, K., Hendrix, MG., Friedrich, AW., (2009): Cross-border comparison of the admission prevalence and clonal structure of methicillin-resistant Staphylococcus aureus. J. Hosp. Infect. 71(4),320–6.
- Köck, R., Siam, K., Al-Malat, S., Christmann, J., Schaumburg, F., Becker, K., Friedrich, A.W., (2011): Characteristics of hospital patients colonized with livestock-associated meticillin-resistant Staphylococcus aureus (MRSA) CC398 versus other MRSA clones. J. Hosp. Infect. 79(4), 292–6.
- Köck, R., Loth, B., Köksal, M., Schulte-Wülwer, J., Harlizius, J., Friedrich, A.W., (2012): Persistence of nasal colonization with livestock-associated methicillin-resistant Staphylococcus aureus in pig farmers after holidays from pig exposure. Appl. Environ. Microbiol.78(11),4046–4047.
- Köck R, Schaumburg F, Mellmann A, Koksal M, Jurke A, Becker K, et al. (2013): Livestock‐associated methicillin‐resistant Staphylococcus aureus (MRSA) as causes of human infection and colonization in Germany. PLoS One. 8(2):e55040.
- Köck R, Winner K, Schaumburg F, Jurke A, Rossen JWA, Friedrich AW. (2014): Admission prevalence and acquisition of nasal carriage of meticillin‐resistant Staphylococcus aureus (MRSA) in German rehabilitation centres. J Hosp Infect. 87(2):115‐8.
- Kramer, A, Hübner, NO, Steinmetz, I. (2009): MRSA-Screening am Universitätsklinikum Greifswald – Ergebnisse, Erfahrungen. www.gdi-mv.de/_downloads/hering_kramer.pdf
- Kreausukon K, Fetsch A, Kraushaar B, Alt K, Müller K, Krömker V, Zessin KH, Käsbohrer A, Tenhagen BA.(2012): Prevalence, antimicrobial resistance, and molecular characterization of methicillin-resistant Staphylococcus aureus from bulk tank milk of dairy herds. J Dairy Sci. 95(8):4382-8
- Layer, F., Cuny, C., Strommenger, B., Werner, G., Witte, W., (2012): Aktuelle Daten und Trends zu Methicillin-resistenten Staphylococcus aureus (MRSA). Bundesgesundheitsbl. 55(11-12):1377-86.
- Layer F, Werner G, Cuny C, Strommmenger B.(2013): Eigenschaften, Häufigkeit und Verbreitung von MRSA in Deutschland – Update 2011/2012. Epidemiologisches Bulletin 27. Mai 2013 / Nr. 21
- Lekkerkerk WS, van de Sande-Bruinsma N, van der Sande MA, Tjon-A-Tsien A, Groenheide A, (2012): Emergence of MRSA of unknown origin in the Netherlands. Clin Microbiol Infect 18: 656–661.
- Lin J, Yeh KS, Liu HT, Lin JH. (2009): Staphylococcus aureus isolated from pork and chicken carcasses in Taiwan: prevalence and antimicrobial susceptibility. JFood Prot. 72(3):608-11.
- Loncaric I, Stalder GL, Mehinagic K, Rosengarten R, Hoelzl F2, Knauer F, Walzer C (2013).Comparison of ESBL - And AmpC Producing Enterobacteriaceae and Methicillin-Resistant Staphylococcus aureus (MRSA) Isolated from Migratory and Resident Population of Rooks (Corvus frugilegus) in Austria. PLoS One. 8(12):e84048
- Lowder, B.V., Guinane, C.M., Ben Zakour, N.L., Weinert, L.A., Conway-Morris, A., Cartwright, R.A., Simpson, A.J., Rambaut, A., Nubel, U., and Fitzgerald, J.R., (2009): Recent human-to-poultry host jump, adaptation, and pandemic spread of Staphylococcus aureus. Proc. Natl. Acad. Sci. USA. 106, 19545–19550.
- McCarthy, A.J., Witney, A.A., Gould, K.A., Moodley, A., Guardabassi, L., Voss, A., Denis, O., Broens, E.M., Hinds, J., Lindsay, J.A. (2011): The distribution of mobile genetic elements (MGEs) in MRSA CC398 is associated with both host and country. Genome Biol. Evol. 3, 1164–1174.
- Meyer, M., (1967): A proposal for subdividing the species Staphylococcus aureus. Int. J. Syst. Bacteriol. 17, 387–389.
- Mulders, M.N., Haenen, A.P., Geenen, P.L., Vesseur, P.C., Poldervaart, E.S., Bosch, T., Huijsdens, X.W., Hengeveld, P.D., Dam-Deisz, W.D., Graat, E.A., Mevius, D., Voss, A., Van De Giessen, A.W., (2010): Prevalence of livestock-associated MRSA in broiler flocks and risk factors for slaughterhouse personnel in The Netherlands. Epidemiol. Infect. 138(5),743–55.
- O'Brien, AM., Hanson, BM., Farina, SA., Wu, JY., Simmering, JE., Wardyn, SE., Forshey, BM., Kulick, ME., Wallinga, DB., Smith, TC. (2012): MRSA in conventional and alternative retail pork products. PLoS One.7(1):e30092.
- Pantosti, A., (2012): Methicillin-resistant Staphylococcus aureus associated with animals and its relevance to human health. Front Microbiol. 3:127.
- Paterson GK, Larsen AR, Robb A, Edwards GE, Pennycott TW, Foster G, et al. (2012): The newly described mecA homologue, mecALGA251, is present in methicillin-resistant Staphylococcus aureus isolates from a diverse range of host species. J Antimicrob Chemother. 67(12):2809-13.
- Petersen A, Stegger M, Heltberg O, Christensen J, Zeuthen A, Knudsen LK, Urth T, Sorum M, Schouls L, Larsen J, Skov R, Larsen AR.(2013): Epidemiology of methicillin-resistant Staphylococcus aureus carrying the novel mecC gene in Denmark corroborates a zoonotic reservoir with transmission to humans. Clin. Microbiol. Infect.19:E16-E22.
- Price, L.B., Stegger, M., Hasman, H., Aziz, M., Larsen, J., Andersen, P.S., Pearson, T., Waters, A.E., Foster, J.T., Schupp, J., Gillece, J., Driebe, E., Liu, C.M., Springer, B., Zdovc, I., Battisti, A,, Franco, A., Zmudzki, J., Schwarz, S., Butaye, P., Jouy, E., Pomba, C., Porrero, M.C., Ruimy, R., Smith, T.C., Robinson, D.A., Weese, J.S., Arriola, C.S., Yu, F., Lautend, F., Keim, P., Skov, R., Aarestrup, F.M. (2012): Staphylococcus aureus CC398: host adaptation and emergence of methicillin resistance in livestock. MBio. 3(1) 40305–11.
- Pu, S., Han, F., Ge, B., (2009): Isolation and characterization of methicillin-resistant Staphylococcus aureus strains from Louisiana retail meats. Appl Environ Microbiol. 75(1):265-7.
- Richter, A., Sting, R., Popp, C.D., Rau, J.U., Tenhagen, B.-A., Gueraa, B., Hafez, H.M., Fetsch, A., (2012): Prevalence and types of methicillin-resistant Staphylococcus aureus in turkey flocks and personnel attending the animals. Epidemiol. Infect. 10, 1–10.
- RKI/KRINKO (2008): Kommentar zu den „Empfehlungen zur Prävention und Kontrolle von MRSA-Stämmen in Krankenhäusern und anderen medizinischen Einrichtungen“. Epid Bull 42: 363.
- Sánchez García, M., De la Torre, MA., Morales, G., Peláez, B., Tolón, MJ., Domingo, S., Candel, FJ., Andrade, R., Arribi, A., García, N., Martínez Sagasti, F., Fereres, J., Picazo, J.,(2010): Clinical outbreak of linezolid-resistant Staphylococcus aureus in an intensive care unit. JAMA 303(22):2260-4.
- Schulz, J., Friese, A., Klees, S., Tenhagen, B.A., Fetsch, A., Rösler, U., Hartung, J., (2012):Longitudinal study of the contamination of air and of soil surfaces in the vicinity of pig barns by livestock-associated methicillin-resistant Staphylococcus aureus. Appl. Environ. Microbiol.78(16), 5666–5671.
- Strommenger B, Kehrenberg C, Kettlitz C, Cuny C, Verspohl J, Witte W, Schwarz S. (2006): Molecular characterization of methicillin-resistant Staphylococcus aureus strains from pet animals and their relationship to human isolates. J Antimicrob Chemother. 57(3), 461-5.
- Tenhagen, BA., Fetsch, A., Stührenberg, B., Schleuter, G., Guerra, B., Hammerl, JA., Hertwig, S., Kowall, J., Kämpe, U., Schroeter, A., Bräunig, J., Käsbohrer, A., Appel, B. (2009): Prevalence of MRSA types in slaughter pigs in different German abattoirs. Vet Rec. 14;165 (20):589-93.
- Torres, C. (2014) Characterization of tetracycline and methicillin resistant Staphylococcus aureus strains in a Spanish hospital: is animal contact a risk factor in infections caused by MRSA CC398? Int J Med Microbiol.304.
- Uhlemann, A.C., Porcella, S.F., Trivedi, S., Sullivan, S.B., Hafer, C., Kennedy, A.D., Barbian, K.D., McCarthy, A.J., Street, C., Hirschberg, D.L., Lipkin, W.I., Lindsay, J.A., De Leo, F.R., Lowy, F.D., (2012): Identification of a highly transmissible animal-independent Staphylococcus aureus ST398 clone with distinct genomic and cell adhesion properties. MBio.3 (2). pii: e00027-12.
- van Alen S, Ballhausen B, Peters G, Friedrich AW, Mellmann A, Köck R, Becker K. (2016): In the centre of an epidemic: Fifteen years of LA-MRSA CC398 at the University Hospital Münster. Vet Microbiol. S0378-1135(16)30021-9.
- van Cleef, BA., Verkade, EJ., Wulf, MW., Buiting, AG., Voss, A., Huijsdens, XW., van Pelt, W., Mulders, MN., Kluytmans, JA. (2010 a): Prevalence of livestock-associated MRSA in communities with high pig-densities in The Netherlands. PLoS One. 5 (2):e9385
- van Cleef, BA., Broens, EM., Voss, A. (2010 b): High prevalence of nasal MRSA carriage in slaughterhouse workers in contact with live pigs in The Netherlands. Epidemiol. Infect. 138, 756–763.
- van Cleef, BA., Graveland, H., Haenen, AP., van de Giessen, AW., Heederik, D., Wagenaar, JA., Kluytmans, JA. (2011 a): Persistence of livestock-associated methicillin-resistant Staphylococcus aureus in field workers after short-term occupational exposure to pigs and veal calves. J. Clin.Microbiol. 49 (3), 1030–1033.
- 75. van Cleef, BA., Monnet, DL., Voss, A., Krziwanek, K., Allerberger, F., Struelens, M., Zemlickova, H., Skov, RL., Vuopio-Varkila, J., Cuny, C., Friedrich, AW., Spiliopoulou, I., Pászti, J., Hardardottir, H., Rossney, A., Pan, A., Pantosti, A., Borg, M., Grundmann, H., Mueller-Premru, M., Olsson-Liljequist, B., Widmer, A., Harbarth, S., Schweiger, A., Unal, S., Kluytmans, JA. (2011 b): Livestock-associated methicillin-resistant Staphylococcus aureus in humans, Europe. Emerg Infect Dis. 17 (3):502-5.
- Van den Eede A, Hermans K, Van den Abeele A, Floré K, Dewulf J, Vanderhaeghen W, Crombé F, Butaye P, Gasthuys F, Haesebrouck F, Martens A. (2012): Methicillin-resistant Staphylococcus aureus (MRSA) on the skin of long-term hospitalised horses. Vet J. 193(2):408-11.
- Van den Eede A, Martens A, Floré K, Denis O, Gasthuys F, Haesebrouck F, Van den Abeele A, Hermans K. (2013): MRSA carriage in the equine community: an investigation of horse-caretaker couples. Vet Microbiol. 163(3-4):313-8.
- van Rijen MM, Kluytmans-van den Bergh MF, Verkade EJ, Ten Ham PB, Feingold BJ, Kluytmans JA. (2013): Lifestyle-Associated Risk Factors for Community-Acquired Methicillin-Resistant Staphylococcus aureus Carriage in the Netherlands: An Exploratory Hospital-Based Case-Control Study. PLoS One. 8(6):e65594.
- Vanderhaeghen W, Cerpentier T, Adriaensen C, Vicca J, Hermans K, Butaye P. (2010): Methicillin-resistant Staphylococcus aureus (MRSA) ST398 associated with clinical and subclinical mastitis in Belgian cows. Vet Microbiol. 144(1-2):166-71.
- Verkade E, van Benthem B, Kulytmans- van den Bergh M, van Cleef B, van Rijen M, Bosch T, Kluytmans J. (2013): Dynamics and Determinants of Staphylococcus aureus Carriage in Livestock Veterinarians: a prospective cohort study. Clin Infect Dis. 57(2) e11-e17.
- Vincze, S., Stamm, I., Kopp, P.A., Hermes, J., Adlhoch, C., Semmler, T., Wieler, L.H., Lübke-Becker, A., Walther, B., 2014: Alarming proportions of methicillin-resistant Staphylococcus aureus (MRSA) in wound samples from companion animals, Germany 2010-2012. PLoS One. 9:e85656.
- Voss, A., Loeffen, F., Bakker, J., Klaassen, C., Wulf, M. (2005): Methicillin-resistant Staphylococcus aureus in pig farming. Emerg Infect Dis. 11, 1965–1966.
- Vossenkuhl B, Brandt J, Fetsch A, Käsbohrer A, Kraushaar B, Alt K, Tenhagen,B A.(2014): Comparison of spa Types, SCCmec Types and Antimicrobial Resistance Profiles of MRSA Isolated from Turkeys at Farm, Slaughter and from Retail Meat Indicates Transmission along the Production Chain. BA. PLoS One. 9(5):e96308
- Walther B, Wieler LH, Friedrich AW, Kohn B, Brunnberg L, Lübke-Becker A. (2009): Staphylococcus aureus and MRSA colonization rates among personnels and dogs in a small animal hospital:Association with nosocomial infections. Berl Münch Tierärztl Wochenschr 122 (5/6):178-185.
- Walther B, Hermes J, Cuny C, Wieler LH, Vincze S, et al.(2012 a): Sharing More than Friendship — Nasal Colonization with Coagulase-Positive Staphylococci (CPS) and Co-Habitation Aspects of Dogs and Their Owners. PLoS ONE 7(4): e35197.
- Walther B, Wieler LH, Vincze S, Antão EA, Brandenburg A, Stamm I, Kopp PA, Kohn B, Semmler T, Lübke-Becker A. (2012 b): MRSA Variant in Companion Animals. Emerg Infect Dis. 18(12): 2017–2020.
- Walter J, Espelage W, Cuny C, Jansen A, Witte W, Eckmanns T, Hermes J. (2016).Veterinarians Visiting Swine Farms Are at High Risk for Colonization With Livestock-Associated Methicillin-Resistant Staphylococcus aureus. Clin Infect Dis. 62(1):126-8.
- Wassenberg MW, Bootsma MC, Troelstra A, Kluytmans JA, Bonten MJ, (2011):Transmissibility of livestock-associated methicillin-resistant Staphylococcus aureus (ST398) in Dutch hospitals.Microbiol.Infect. 17,316.
- Weese JS, Reid-Smith R, Rousseau J, Avery B, (2010): Methicillin-resistant Staphylococcus aureus (MRSA) contamination of retail pork. Can Vet J. 51(7):749-52.
- Witte W, Strommenger B, Stanek C, Cuny C, (2007): Methicillin-resistant Staphylococcus aureus ST398 in humans and animals, Central Europe. Emerg Infect Dis. 13(2):255-8.
- Wulf MW et al. First outbreak of methicillin-resistant Staphylococcus aureus ST398 in a Dutch hospital, June 2007. Euro Surveill. 2008 Feb 28;13(9)
- Zhao, C., Liu, Y., Zhao, M., Liu, Y., Yu, Y., Chen, H., Sun, Q., Chen, H., Jiang, W., Liu, Y., Han, S., Xu, Y., Chen, M., Cao, B., Wang, H. (2012): Characterization of community acquired Staphylococcus aureus associated with skin and soft tissue infection in Beijing: high prevalence of PVL+ ST398. PLoS One. 7(6):e38577.
nach oben
ESBL-bildende Enterobacteriaceae bei Mensch und Tier
Dr. Yvonne Pfeifer, Prof. Dr. Wolfgang Witte, PD Dr. Guido Werner, Robert Koch-Institut
ESBL steht für Extended-Spektrum β-Laktamase, eine Antibiotikaresistenz-Eigenschaft gram-negativer Infektionserreger. Die β-Laktamasen sind bakterielle Enzyme, die β-Laktam-Antibiotika hydrolysieren und damit unwirksam machen. Rückblickend betrachtet betraf dies zunächst und in den 1960er Jahren beginnend die „klassischen“ Penicilline (Ampicillin, Carbenicillin), später, nach 1974, dann auch die Acylureidopenicilline (Azlocillin, Mezlocillin, Piperacillin). Die Gene für diese β-Laktamasen sind zumeist auf Plasmiden lokalisiert, welche zwischen Bakterien ausgetauscht werden können, was letztendlich die weite Verbreitung dieser Enzyme ermöglicht. Heute sind mehr als 50% aller aus ambulant erworbenen, unkomplizierten Harnwegsinfektionen isolierten Escherichia coli-Isolate resistent gegen Ampicillin [1].
1978 wurde Cefotaxim als erstes der sogenannten neueren Cephalosporine (3. und 4. „Generation“ innerhalb dieser Substanzgruppe) in die antibakterielle Chemotherapie eingeführt. Seit 1986 wurde zunächst vereinzelt, dann zunehmend über das Auftreten von Enterobacteriaceae-Isolaten mit Resistenz gegen diese neueren Cephalosporine berichtet. Die nähere Analyse ergab, dass bereits weit verbreitete β-Laktamasen durch Aminosäureaustausche infolge von Mutationen auch neuere Cephalosporine hydrolysieren konnten [2]. Diese β-Laktamasen haben somit ein erweitertes Substratspektrum (engl. „extended spectrum“) im Vergleich zu ihren Vorläufern, daher der Name ESBL.
In den 1990er Jahren traten dann Enterobacteriaceae mit phänotypischen ESBL-Eigenschaften und damals neuen β-Laktamasen, den CTX-M-Enzymen auf. Diese Enzyme sind zwar mit den konventionellen ESBL verwandt, die sie kodierenden Gene stammen allerdings aus anderen Bakterien (Kluyvera spp.), von denen aus sie mehrfach und unabhängig voneinander auf Enterobacteriaceae, insbesondere die Spezies Escherichia coli (E. coli) und Klebsiella pneumoniae übertragen wurden [3]. Auch die ESBL-Gene der CTX-M-Gruppe sind „mobil“, d.h. sie liegen auf verschiedenen Plasmiden. Es handelt sich hierbei vor allem um Plasmide, die einen breiten Wirtsbereich besitzen (d.h. sie können zwischen unterschiedlichen Enterobacteriaceae-Arten übertragen werden) und die oft noch weitere Resistenzgene tragen, die Resistenzen gegen andere Antibiotika vermitteln.
nach oben
Vorkommen von ESBL-bildenden Darmbakterien beim Menschen
Seit 2004 wird europaweit und auch in Deutschland ein deutlicher Anstieg der Häufigkeit von Enterobacteriaceae mit ESBL in mikrobiologisch-diagnostischen Proben beobachtet. In E. coli ist die ESBL-Bildung eng mit der Resistenz gegenüber 3. Gen. Cephalosporinen, insbesondere Cefotaxim, assoziiert, d.h. mehr als 90% der Cefotaxim-resistenten Isolate sind ESBL-Bildner. In Deutschland stieg bei E. coli aus Blutkulturen der Anteil ESBL-positiver bzw. Cefotaxim-resistenter Isolate von 1,7% im Jahr 2002 auf 10,5% im Jahr 2014 [4]. Das am RKI lokalisierte Antibiotikaresistenz-Surveillance-System ARS (https://ars.rki.de) zeigte einen deutlichen Anstieg der Cefotaximresistenz für E. coli-Nachweise im Krankenhaus allgemein (6,5 % in 2008; 12,6% in 2014), auf Intensivstationen (9,7% in 2008; 16,4% in 2014) und auch im ambulanten Bereich (2,9% in 2008; 7,5% in 2014). Diese Entwicklung ist verbunden mit der weltweit beschriebenen Verbreitung von ESBL der CTX-M-Gruppe [3].
Für die Bestimmung der Häufigkeit und geografischen Verteilung von ESBL in Deutschland wurde am RKI in den Jahren 2004, 2008 und 2011 eine repräsentative Stichprobe von phänotypisch ESBL-positiven E. coli-Isolaten untersucht [5]. In den Proben wurden zu mehr als 90% CTX-M-Enzyme als Resistenzursache identifiziert; Variante CTX-M-15, welche Cephalosporine der 3. Generation besonders effektiv hydrolysieren kann, war besonders häufig (> 50% aller CTX-M-ESBL); die zweithäufigste Variante war CTX-M-1 (>30% aller CTX-M-ESBL).
Insbesondere E. coli mit ESBL sind nicht nur als Infektionserreger in Krankenhäusern verbreitet, sie können auch bei ambulant-erworbenen Infektionen auftreten, u.a. bei Harnwegsinfektionen. Eine bestimmte klonale Line, benannt als E. coli Sequenztyp 131 (ST131), stellte in einer Deutschland-weit durchgeführten Untersuchung einen Anteil von 30-40% bei Isolaten aus nosokomialen Infektionen bzw. ambulanten Harnwegsinfektionen [6]. E. coli-ST131 ist häufig mit der ESBL-Variante CTX-M-15 sowie zusätzlicher Resistenz gegenüber Fluorchinolonen (z.B. Ciprofloxacin) assoziiert und ist insgesamt weltweit der dominante Sequenztyp im humanmedizinischen Bereich [7]. Neue Studien deuten darauf hin, dass der Erfolg von E. coli-ST131 nicht nur allein auf der Selektion durch Antibiotikaeinsatz im humanmed. Bereich beruht sondern dass verschiedene Stammeigenschaften eine wirtspezifische Kolonisation ermöglichen [8].
Cephalosporin-empfindliche E. coli und andere Enterobacteriaceae sind Bestandteil der normalen Darmflora des Menschen, der Säugetiere, Vögel und Reptilien. Eine Besiedelung mit oral aufgenommenen ESBL-bildenden E. coli ist grundsätzlich möglich, wie Erkenntnisse aus Studien bei Reiserückkehrern [9] oder im Rahmen von Lebensmittelassoziierten Ausbrüchen zeigen [10]. Die Dauer der anschließenden Kolonisation kann mehrere Monate betragen und wird z.T. von Selektionsdruck durch interkurrente Antibiotikaanwendungen mitbestimmt.
Die Resistenzdaten von ARS im ambulanten Bereich und verschiedene Studien in Deutschland, wie z.B. ein ESBL-Screening bei Patientenaufnahme in Krankenhäuser [11] bzw. ein ESBL-Screening bei Altenheimpatienten [12] und gesunden Probanden [13], deuten darauf hin, dass auch E. coli mit ESBL als Darmbesiedler bei ca. 6% der Menschen in der gesunden Bevölkerung vorhanden sind. Über diese asymptomatischen Träger gelangen ESBL-bildende Keime in Krankenhäuser, doch aus einer solchen Darmbesiedlung entwickelt sich nicht unbedingt eine Krankenhausinfektion. Dies ist nur der Fall, wenn dafür bestimmte (Prä-)Dispositionen von Seiten der Patienten vorhanden sind. Es ist bekannt, dass die ESBL-Gene im Darm zwischen verschiedenen E. coli-Stämmen ausgetauscht oder auf weitere Enterobacteriaceae-Spezies übertragen werden und sich auf diese Weise weiter verbreiten können [3].
nach oben
Vorkommen von ESBL-bildenden Darmbakterien bei (Mast)-Tieren
Resistenzen entwickeln sich im Wechselspiel von genetischen Ereignissen und Selektion. Genetische Ereignisse sind Mutationen oder die Aufnahme von Resistenzgenen aus der Umgebung. Selektion bedeutet, dass bei der Anwendung von Antibiotika solche Bakterienstämme überleben, die eine Resistenz besitzen. Daher breiten sich Bakterien mit Resistenzeigenschaften vor allem dort aus, wo der Selektionsdruck zugunsten der Resistenz infolge des Antibiotikaeinsatzes hoch ist. Das sind neben Krankenhäusern auch Anlagen der industriellen Tiermast.
In Deutschland wurden im Januar 2012 erste Ergebnisse von ESBL-Untersuchungen in verschiedenen Beständen (Schwein, Rind, Geflügel) veröffentlicht, die im Rahmen des interdisziplinären BMBF-geförderten Forschungsverbundes RESET durchgeführt werden (www.reset-verbund.de). Danach wurden im Großteil der Schweine bzw. Geflügelbestände ESBL-E. coli (darunter ein hoher Anteil CTX-M-ESBL) nachgewiesen [14, 15]. Allerdings war die in E. coli beim Menschen häufigste Variante CTX-M-15 beim Tier nur sehr selten nachweisbar [16]. Insbesondere in Geflügelbeständen wurden nicht nur ESBL sondern auch Plasmid-vermittelte AmpC-Beta-Laktamasen des Types CMY (Anteil bis zu 20%) als Ursache der Dritt-Generations-Cephalosporin-Resistenz identifiziert [14]. Eine schwedische Studie zeigte, dass die Ursachen hierfür in den Zuchtlinien liegen und sich die CMY-E. coli Besiedlung ausgehend von den Großelterngenerationen durch die gesamte Produktionskette zieht [17].
ESBL-Infektionen werden in der Humanmedizin sehr oft und erfolgreich mit Carbapenemen behandelt. Eine schleichende Zunahme Carbapenem-resistenter Enterobacteriacae, deren Ursache oft die Bildung spezieller β-Laktamasen - sog. Carbapenemasen - ist, wird weltweit seit mehr als 10 Jahren mit Besorgnis beobachtet [18]. Im Jahr 2011 wurden erstmals Carbapenemase-produzierenden E. coli und Salmonella in deutschen Nutztierbeständen identifiziert [19]. Es handelte sich um einzelne Isolate aus Mastanalagen für Schweine und Geflügel, die die Metallo-Beta-Laktamase VIM-1 produzierten. Dabei zeigten sich die Schwierigkeiten in der Diagnostik solcher Isolate, denn die MHK-Werte für Imipenem lagen nur im intermediären Bereich. Isolate aus der Humanmedizin sind dagegen oft voll Carbapenem-resistent, da weitere Resistenzmechanismen, neben der Carbapenemase-Bildung, dazu beitragen. Carbapenem-resistente Stämme sind zugleich gegen eine Vielzahl anderer β-Laktam-Antibiotika resistent und können daher durch deren Einsatz selektiert und in ihrer Verbreitung gefördert werden [18].
Dem NRZ für gramnegative Krankenhauserreger wurden im Jahr 2014 fast 4.800 Isolate aus Laboratorien aus ganz Deutschland zur Abklärung einer verminderten Empfindlichkeit gegen Carbapeneme eingesandt. Eine Carbapenemase fand sich bei 2.522 Isolaten [20]. Die häufigsten Carbapenemasen in Enterobacteriaceae sind OXA-48, KPC, VIM und NDM. Ein Teil der betroffenen Patienten war vorher im Ausland hospitalisiert oder war Reiserückkehrer aus einem Land mit hoher Prävalenz Carbapenem-resistenter Erreger. Es wurden in den letzten Jahren mehrere Ausbrüche durch Carbapenemase-bildenden Bakterien, insbesondere verursacht durch KPC-bildende Klebsiella pneumoniae, gemeldet. Da Besiedlungen mit diesen multiresistenten Erregern nicht in allen Krankenhäusern konsequent gesucht und verfolgt werden, ist eine regionale Verbreitung Carbapenemase-bildender Stämme oder der entsprechenden Resistenzgene möglich [21, 22]. Bei Haustieren in Deutschland wurden in 2012 über die ersten OXA-48 Carbapenemase-bildenden E. coli bzw. K. pneumoniae berichtet. Eine Übertragung von Mensch zu Tier wird hier als Ursache diskutiert [23].
nach oben
Übertragung von ESBL-bildenden Darmbakterien vom Tier auf den Menschen
Die Verbreitung übertragbarer Antibiotikaresistenzgene zwischen Menschen und Masttieren ist schon seit Längerem bekannt [24]. Anders als bei Methicillin-resistentem Staphylococcus aureus (MRSA) erfolgt die Aufnahme von Darmbakterien, wie ESBL-bildende E. coli, vorrangig über den fäkal-oralen Weg. Hinsichtlich des umsichtigen Umgangs mit rohen Lebensmitteln wie Salat und rohem (Geflügel-) Fleisch wird auf die Empfehlungen des Bundesinstituts für Risikobewertung [25] hingewiesen.
Grundsätzlich ist sowohl die Übertragung des ESBL-bildenden Stammes als auch die Weitergabe des ESBL-Gen-tragenden Plasmides denkbar. Untersuchungen zu ESBL-bildenden Salmonellen zeigen, dass die Durchfallerkrankungen des Menschen zumeist durch die direkte Übertragung eines Salmonellen-Stammes vom Tier(produkt) verursacht werden. Da ESBL-Bildung bei Salmonellen insgesamt sehr selten vorkommt (<1%), ist es jedoch möglich, dass diese ESBL-Gene von resistenten E. coli-Stämmen, die den Darm von Tier oder Mensch besiedeln, erworben wurden. [26, 27]. Studien aus den Niederlanden belegen, dass ESBL-E. coli von Hühnerfleischprodukten z.T. die gleichen Eigenschaften (ähnliche Resistenzplasmide oder ähnliche E. coli-Stämme) aufweisen, wie ESBL-E. coli aus Infektionen bei Menschen [28, 29]. Außerdem wurden bei Menschen mit Tätigkeit in Schweinemastanlagen sehr ähnliche ESBL-E. coli als Darmbesiedler gefunden, wie bei den entsprechenden Masttieren [30]. In Schweden wurde gezeigt, dass bei E. coli von importiertem Mastgeflügel mit der AmpC-β-Laktamase CMY-2 das entsprechende Gen auf den gleichen Plasmiden lokalisiert war wie bei CMY-2 positiven Stämmen aus Infektionen vom Menschen [31]. Bei ESBL-E.coli von Geflügelfleischproben, die in Deutschland untersucht wurden, war die β-Laktamase vom Typ CTX-M-1 am häufigsten vertreten; bei ESBL-E. coli vom Menschen beträgt dieser Anteil ~30% [32, 33]. Derzeit konzentrieren sich die weiteren Analysen auf den Vergleich von ESBL-E. coli Stämmen von Mensch und Tier. Der beim Menschen sehr häufig vorkommende Sequenztyp E. coli-ST131 wurde in mehreren Fällen auch bei Haustieren und auch Wildtieren nachgewiesen; bei Nutztieren ist er jedoch sehr selten. Daher wird vermutet, dass der Erfolg dieses ESBL-bildenden Sequenztypes sowohl auf der Anpassung an den Menschen und auf die Selektion durch Antibiotika im humanmedizinischen Bereich beruht [6, 7]. Weitere ESBL-bildende Sequenztypen, wie E. coli-ST410, E. coli-ST10 oder E. coli-ST38 kommen zu ähnlichen Anteilen bei Mensch und Tier vor [6, 34], weshalb derzeit weitere Genom-Vergleiche erfolgen, um beurteilen zu können in welchem Ausmaß das Vorkommen von ESBL-Bildnern beim Nutztier zur Verbreitung von ESBL-Bildnern beim Menschen beiträgt.
Der Erwerb von ESBL-Bildnern als Besiedler durch den Menschen ist offensichtlich vielgestaltig. ESBL-E. coli wurden z.B. auch als Besiedler bei Vegetariern in gleicher Häufigkeit wie bei der Bevölkerung in Deutschland allgemein nachgewiesen [35]. Dies überrascht nicht, da auch von ESBL-Nachweisen auf Gemüse berichtet wurde [36, 37]. Ein weiterer Eintrag von ESBL-bildenden Keimen in Gewässer und deren Bewohner ist möglicherweise verursacht durch die Düngung der Äcker mit kontaminierter Gülle von Tier und Mensch [38, 39]. In diesem Zusammenhang ist auch auf die mögliche Verbreitung von ESBL-E. coli durch Vögel mit einem größeren Aktionsradius, wie z.B. Saatkrähen, hinzuweisen [40].
Der Transport ESBL-bildender E. coli als unauffällige Darmbesiedlung erfolgt sehr schnell über ganze Kontinente. Wie eine aktuelle Studie aus Deutschland gezeigt hat, können ESBL-E. coli auch durch Reisetätigkeit erworben werden, so gab es Nachweise bei 30% der Reiserückkehrer aus Asien, die vorher diesbezüglich negativ waren [9]. In Deutschland wird die Frage der Verbreitungswege ESBL-bildender Keime gegenwärtig schwerpunktmäßig im Rahmen des durch das BMBF-geförderten Verbundprojektes RESET bearbeitet, an dem sowohl Human- als auch Veterinärmediziner mitwirken (www.reset-verbund.de). Unbekannt ist bisher noch, ob die Übertragung von Enterobacteriaceae mit ESBL zu einer vorübergehenden oder auch ständigen Besiedlung mit ESBL-bildenden Enterobacteriaceae führt und was die Ursachen für diese sind.
Wenn die Häufigkeit der Resistenz gegen neuere Cephalosporine weiter ansteigt, dann bleiben infolge der Mehrfachresistenz gegen weitere Antibiotika letztlich nur noch die Carbapeneme zur Behandlung im Falle einer Infektion. Allerdings zeichnen sich auch mit dem Erwerb von Carbapenemresistenzen bedrohliche Resistenzentwicklungen ab, die zu Infektionen führen, die letztlich kaum mehr antibiotisch zu behandeln sind [18, 41]. Neue Antibiotika für die Behandlung von Infektionen mit derart resistenten Erregern sind gegenwärtig nicht in Sicht; es wird derzeit auf alte Substanzen, wie das Colistin, zurückgegriffen. Der häufige Nachweis von E. coli mit plasmid-vermittelter Colistinresistenz bei Nutztieren und bei Fleischprodukten in China und in geringem Anteil (~1%) auch bei Isolaten aus Infektionen beim Menschen [42] erregte Ende 2015 international große Aufmerksamkeit und initiierte Untersuchungen in vielen Ländern. In Deutschland wurden in ersten Untersuchungen bereits einzelne ESBL-E. coli vom Schwein aber auch ein multiresistentes klinisches Isolat mit dieser Colistinresistenz gefunden [43]. Dieses aktuelle Beispiel weist auf das dringende Erfordernis einer interdisziplinär angelegten, strengen Überwachung der Resistenzsituation und die Erforschung der zugrunde liegenden Mechanismen und Verbreitungswege resistenter Erreger bei Mensch und Tier hin. Daraus abzuleitende Maßnahmen zur Prävention der weiteren Verbreitung und der Verminderung des antibiotischen Selektionsdruckes sind nicht einseitig zu betrachten und sind ein gemeinsames Anliegen von Human- und Veterinärmedizin wie es auch in der Deutschen Antibiotika-Resistenzstrategie DART dargelegt ist [44].
nach oben
Literatur
- Wagenlehner FM, Wagenlehner C, Savov O, Gualco L, Schito G, Naber KG. [Clinical aspects and epidemiology of uncomplicated cystitis in women. German results of the ARESC Study]. Urologe A. 2010; 49:253-261.
- Paul GC et al. TEM-4, a new plasmid-mediated beta-lactamase that hydrolyzes broad-spectrum cephalosporins in a clinical isolate of Escherichia coli. Antimicrob Agents Chemother. 1989; 33: 1958-1963.
- Cantón R1, González-Alba JM, Galán JC. CTX-M Enzymes: Origin and Diffusion. Front Microbiol. 2012 Apr 2;3:110. doi: 10.3389/fmicb.2012.00110. eCollection 2012.
- European Centre for Disease Preventon and Control. Antimicrobial resistance surveillance in Europe 2014. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: ECDC; 2015.
- Pfeifer Y, Eller C. Aktuelle Daten und Trends zur Beta-Lactam-Resistenz bei gramnegativen Infektionserregern. Bundesgesundheitsblatt 2012; 55: 1405-1409.
- Pietsch M, Eller C, Wendt C, Holfelder M, Falgenhauer L, Fruth A, Grössl T, Leistner R, Valenza G, Werner G, Pfeifer Y; RESET Study Group. Molecular characterisation of extended-spectrum β-lactamase (ESBL)-producing Escherichia coli isolates from hospital and ambulatory patients in Germany. Vet Microbiol. 2015; pii: S0378-1135(15)30097-3. doi: 10.1016/j.vetmic.2015.11.028. [Epub ahead of print].
- Rogers BA, Sidjabat HE, Paterson DL. Escherichia coli O25b-ST131: a pandemic, multiresistant, community-associated strain. J Antimicrob Chemother 2011; 66: 1-14.
- Kakkanat A, Totsika M, Schaale K, Duell BL, Lo AW, Phan MD, Moriel DG, Beatson SA, Sweet MJ, Ulett GC, Schembri MA. The role of H4 flagella in Escherichia coli ST131 virulence. Sci Rep. 2015 Nov 9;5:16149.
- Lübbert C, Straube L, Stein C, Makarewicz O, Schubert S, Mössner J, Pletz MW, Rodloff AC. Colonization with extended-spectrum beta-lactamase-producing and carbapenemase-producing Enterobacteriaceae in international travelers returning to Germany. Int J Med Microbiol. 2015; 305: 148-156.
- Arvand M, Bettge-Weller G, Fruth A, Uphoff H, Pfeifer Y. Extended-spectrum beta-lactamase-producing Shiga toxin gene (stx1)-positive Escherichia coli O91:H14 carrying blaCTX-M-15 on an IncI1-ST31 plasmid isolated from a human patient in Germany. Int J Med Microbiol. 2015; 305: 404-407.
- Valenza G, Nickel S, Pfeifer Y, Eller C, Krupa E, Lehner-Reindl V, Höller C. Extended-spectrum-β-lactamase-producing Escherichia coli as intestinal colonizers in the German community. Antimicrob Agents Chemother. 2014; 58: 1228-1230.
- Arvand M, Moser V, Pfeifer Y. Prevalence of extended-spectrum-β-lactamase-producing Escherichia coli and spread of the epidemic clonal lineage ST131 in nursing homes in Hesse, Germany. J Antimicrob Chemother. 2013; 68: 2686-2688.
- Leistner R, Meyer E, Gastmeier P, Pfeifer Y, Eller C, Dem P, Schwab F. Risk factors associated with the community-acquired colonization of extended-spectrum beta-lactamase (ESBL) positive Escherichia Coli. an exploratory case-control study. PLoS One. 2013 Sep 11;8(9):e74323. doi: 10.1371/journal.pone.0074323. eCollection 2013.
- Laube H, Friese A, von Salviati C, Guerra B, Käsbohrer A, Kreienbrock L, Roesler U. Longitudinal monitoring of extended-spectrum-beta-lactamase/AmpC-producing Escherichia coli at German broiler chicken fattening farms. Appl Environ Microbiol. 2013; 79: 4815-4820.
- Friese A, Schulz J, Laube H. Faecal occurrence and emissions of livestock-associated methicillin-resistant Staphylococcus aureus (laMRSA) and ESBL/AmpC-producing E. coli from animal farms in Germany. Berl Münch Tierärztl Wochenschr 2013; 126: 175-180.
- Fischer J, Rodriguez I, Baumann B, Beutin L, Schroeter A, Guiral E, Kaesbohrer A, Pfeifer Y, Helmuth R, Guerra B. blaCTX-M-15 producing isolates from non-human sources in Germany. J. Antimicrob. Chemother 2014; 69: 2951-2958.
- Nilsson O, Börjesson S, Landén A, Bengtsson B.Vertical transmission of Escherichia coli carrying plasmid-mediated AmpC (pAmpC) through the broiler production pyramid. J Antimicrob Chemother 2014; 69: 1497-1500.
- Livermore DM, Woodford N. The beta-lactamase threat in Enterobacteriaceae, Pseudomonas and Acinetobacter. Trends Microbiol 2006; 14: 413-420.
- Guerra B, Fischer J, Helmuth R, 2014. An emerging public health problem: Acquired carbapenemase-producing microorganisms are present in food-producing animals, their environment, companion animals and wild birds. Veterinary Microbiology 2014; 171: 290-297.
- Robert-Koch-Institut. Bericht des Nationalen Referenzzentrums (NRZ) für gramnegative Krankenhauserreger. Epidemiologisches Bulletin 2/2016.
- Robert-Koch-Institut. Häufung von KPC-2 produzierenden Stämmen verschiedener Enterobacteriaceae-Spezies in Hessen. Epidemiologisches Bulletin 24/2014.
- Ducomble T, Faucheux S, Helbig U, Kaisers UX, König B, Knaust A, Lübbert C, Möller I, Rodloff AC, Schweickert B, Eckmanns T. Large hospital outbreak of KPC-2-producing Klebsiella pneumoniae: investigating mortality and the impact of screening for KPC-2 with polymerase chain reaction. J Hosp Infect. 2015; 89: 179-185.
- Stolle I, Prenger-Berninghoff E, Stamm I, Scheufen S, Hassdenteufel E, Guenther S, Bethe A, Pfeifer Y, Ewers C. Emergence of OXA-48 carbapenemase-producing Escherichia coli and Klebsiella pneumoniae in dogs. J Antimicrob Chemother. 2013; 68: 2802-2808.
- Witte W. Medical consequences of antibiotic use in agriculture. Science 1998; 279: 996-997.
- BfR: Fragen und Antworten zu ESBL-tragenden antibiotikaresistenten Keimen
- Eller C, Simon S, Miller T, Frick JS, Prager R, Rabsch W, Guerra B, Werner G, Pfeifer Y. Presence of β-lactamases in extended-spectrum-cephalosporin-resistant Salmonella enterica of 30 different serovars in Germany 2005-11. J Antimicrob Chemother 2013; 68: 1978-1981.
- Rodríguez I, Barownick W, Helmuth R, Mendoza MC, Rodicio MR, Schroeter A, Guerra B. Extended-spectrum {beta}-lactamases and AmpC {beta}-lactamases in ceftiofur-resistant Salmonella enterica isolates from food and livestock obtained in Germany during 2003-07. J Antimicrob Chemother. 2009; 64: 301-321.
- Leverstein-van Hall MA, Dierikx CM, Cohen Stuart J, et al. Dutch patients, retail chicken meat and poultry share the same ESBL genes, plasmids and strains. National ESBL surveillance group. Clin Microbiol Infect 2011; 17: 873-80.
- Overdevest I, Willemsen I, Rijnsburger M et al. Extended-spectrum β-lactamase genes of Escherichia coli in chicken meat and humans, The Netherlands. Emerg Infect Dis 2011; 17: 1216-1222.
- Dohmen W, Bonten MJ, Bos ME, van Marm S, Scharringa J, Wagenaar JA, Heederik DJ. Carriage of extended-spectrum β-lactamases in pig farmers is associated with occurrence in pigs. Clin Microbiol Infect. 2015; 21: 917-923.
- Egervärn M, Börjesson S, Byfors S, Finn M, Kaipe C, Englund S, Lindblad M. Escherichia coli with extended-spectrum beta-lactamases or transferable AmpC beta-lactamases and Salmonella on meat imported into Sweden. Int J Food Microbiol. 2014; 171: 8-14.
- Kola A, Kohler C, Pfeifer Y, Schwab F, Kühn K, Schulz K, Balau V, Breitbach K, Bast A, Witte W, Gastmeier P, Steinmetz I. High prevalence of extended-spectrum-β-lactamase-producing Enterobacteriaceae in organic and conventional retail chicken meat, Germany. J Antimicrob Chemother. 2012; 67: 2631-2634.
- Pfeifer Y, Eller C, Rasmus Leistner, Valenza G, Nickel S, Guerra B, Fischer J, Werner G. ESBL-Bildner als Infektionserreger beim Menschen und die Frage nach dem zoonotischen Reservoir. HygMed 2013; 38[7/8]: 294-299.
- Schaufler K, Semmler T, Wieler LH, Wöhrmann M, Baddam R, Ahmed N, Müller K, Kola A, Fruth A, Ewers C, Guenther S. Clonal spread and interspecies transmission of clinically relevant ESBL-producing Escherichia coli of ST410--another successful pandemic clone? FEMS Microbiol Ecol. 2016 Jan;92(1). pii: fiv155. doi: 10.1093/femsec/fiv155. Epub 2015 Dec 9.
- Königer D, Gastmeier P, Kola A, Schwab F, Meyer E. Vegetarians are not less colonized with extended-spectrum-β-lactamase-producing bacteria than meat eaters. Antimicrob Chemother. 2014; 69: 281-282.
- Reuland EA, Al Naiemi N, Raadsen SA, Savelkoul PH, Kluytmans JA, Vandenbroucke-Grauls CM. Prevalence of ESBL-producing Enterobacteriaceae in raw vegetables. Eur J Clin Microbiol Infect Dis. 2014 May 22. [Epub ahead of print]
- Müller A, Stephan R, Nüesch-Inderbinen M. Distribution of virulence factors in ESBL-producing Escherichia coli isolated from the environment, livestock, food and humans. Sci Total Environ. 2016; 541: 667-672.
- von Salviati C, Laube H, Guerra B, Roesler U, Friese A. Emission of ESBL/AmpC-producing Escherichia coli from pig fattening farms to surrounding areas. Vet Microbiol. 2015; 175: 77-84.
- Schauss T, Glaeser SP, Gütschow A, Dott W, Kämpfer P. Improved detection of extended spectrum beta-lactamase (ESBL)-producing Escherichia coli in input and output samples of German biogas plants by a selective pre-enrichment procedure. PLoS One. 2015; 10: e0119791.
- Loncaric I, Stalder GL, Mehinagic K, Rosengarten R, Hoelzl F, Knauer F, Walzer C. Comparison of ESBL-and AmpC producing Enterobacteriaceae and methicillin-resistant Staphylococcus aureus (MRSA) isolated from migratory and resident population of rooks (Corvus frugilegus) in Austria. PLoS One. 2013 Dec 31;8(12):e84048.
- Diene SM, Rolain JM. Carbapenemase genes and genetic platforms in Gram-negative bacilli: Enterobacteriaceae, Pseudomonas and Acinetobacter species. Clin Microbiol Infect 2014; 20: 831-838.
- Liu YY, Wang Y, Walsh TR, Yi LX, Zhang R, Spencer J, Doi Y, Tian G, Dong B, Huang X, Yu LF, Gu D, Ren H, Chen X, Lv L, He D, Zhou H, Liang Z, Liu JH, Shen J. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. Lancet Infect Dis. 2016 Feb; 16: 161-168.
- Falgenhauer L, Waezsada SE, Yao Y, Imirzalioglu C, Käsbohrer A, Roesler U, Michael GB, Schwarz S, Werner G, Kreienbrock L, Chakraborty T; RESET consortium. Colistin resistance gene mcr-1 in extended-spectrum β-lactamase-producing and carbapenemase-producing Gram-negative bacteria in Germany. Lancet Infect Dis. 2016; 16: 282-283.
- http://www.bmg.bund.de/ministerium/meldungen/2015/dart-2020.html
nach oben










