109. Genehmigung nach dem Stammzellgesetz
1. Genehmigungsinhaberin
TWINCORE – Zentrum für Experimentelle und Klinische Infektionsforschung GmbH
2. Zell-Linien
Die genehmigten Forschungsarbeiten erfolgen unter Verwendung der folgenden humanen embryonalen Stammzell-Linien:
- H1 (WiCell Research Institute, Madison, WI, USA)
- H9 (WiCell Research Institute, Madison, WI, USA)
- I3 (Technion ‒ Israel Institute of Technology, Haifa, Israel)
- HES-2 (ES Cell International Pte Ltd, Singapur)
- HES-3 (ES Cell International Pte Ltd, Singapur)
- HUES2 (Harvard University, Cambridge, MA, USA)
- HUES8 (Harvard University, Cambridge, MA, USA)
Die Genehmigung gilt auch für die Verwendung von Sub-Linien (z.B. von klonalen Sub-Linien oder genetisch modifizierten Derivaten) der genannten humanen embryonalen Stammzell-Linien.
3. Angaben zum Forschungsvorhaben
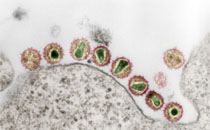
Schwerpunkt des Forschungsvorhabens ist die Etablierung eines Zellmodells, das auf aus humanen embryonalen Stammzellen (hES-Zellen) abgeleiteten leberzellartigen Zellen (hepatocyte like cells, HLC) basiert und an dem insbesondere Wechselwirkungen zwischen dem Hepatitis-C-Virus (HCV) und seinen Wirtszellen untersucht werden sollen. Dazu sollen hES-Zellen zunächst in HLC differenziert und das dafür erforderliche Vorgehen ggf. optimiert werden. Die entstandenen HLC sollen umfassend charakterisiert werden, insbesondere hinsichtlich der Ausstattung mit Lipoproteinen und Komponenten des Fettstoffwechsels. Im Anschluss daran soll die Eignung von HLC als In-vitro-Modell zur Untersuchung bestimmter Aspekte der HCV-Infektion untersucht werden. Dazu soll u. a. die Replikation von HCV in HLC quantifiziert, die Infektiosität der in HLC produzierten HCV-Partikel und deren Zusammensetzung bestimmt sowie Untersuchungen zur Bindung von HCV an die Zelloberfläche, zur Kinetik des Zelleintritts von HCV-Partikeln und zu Fragen von deren intrazellulären Transport durchgeführt werden. Schließlich soll bestimmt werden, welche Veränderungen die HCV-Replikation bzw. die Eigenschaften der HCV-Partikel aufweisen, wenn in HLC die Expression von Genen vermindert bzw. ausgeschaltet wird, die für Proteine mit Relevanz für den Lipidstoffwechsel sowie für Proteine codieren, für die eine Assoziation mit HCV gezeigt wurde bzw. vermutet wird. Ferner soll die Rezeptornutzung von HCV in HLCs untersucht und schließlich analysiert werden, mit welchen Schritten der HCV-Infektion Substanzen interferieren, deren antivirale Wirksamkeit bereits bekannt ist.
In einem weiteren Vorhabensteil soll der Frage nachgegangen werden, ob durch Kokultur sich hepatisch differenzierender hES-Zellen mit verschiedenen anderen in der Leber residierenden Zelltypen (endotheliale Zellen, mesenchymale Zellen etc.) und/oder durch die Kultivierung und Differenzierung der Zellen auf bestimmten extrazellulären Matrizes eine bessere Reifung der HLC erreichbar ist und ob sich entsprechende (Ko)Kultur-Systeme als In-vitro-Modell zur Untersuchung der HCV-Infektion eignen. Ferner sollen aus hES-Zellen abgeleitete Hepatozyten zusammen mit anderen Leberzellen unter 3D-Bedingungen zur Herstellung sog. Leberknospen (liver buds) genutzt und die Replikation von HCV in diesem Gewebemodell untersucht werden.
Die genehmigten Forschungsarbeiten werden vergleichend auch unter Nutzung humaner induzierter pluripotenter Stammzellen (hiPS-Zellen) durchgeführt.
4. Hochrangigkeit der Forschungsziele
Entsprechend der im Antragsverfahren erbrachten wissenschaftlich begründeten Darlegung dienen die genehmigten Forschungsarbeiten unter Verwendung von hES-Zellen nach übereinstimmender Auffassung der Zentralen Ethik-Kommission für Stammzellenforschung und des Robert Koch-Institutes (RKI) hochrangigen Forschungszielen für den wissenschaftlichen Erkenntnisgewinn für die Grundlagenforschung, wobei auch Erkenntnisse mit Relevanz für die Entwicklung neuer therapeutischer Verfahren zur Anwendung beim Menschen entstehen können. Für diese Beurteilung sind folgende Gründe maßgeblich:
Die genehmigten Forschungsarbeiten zielen im wesentlichen darauf, ein Replikationsmodell für die Infektion menschlicher Leberzellen mit HCV zu etablieren, an dem insbesondere Wirtsfaktoren identifiziert werden sollen, die zur Beladung des Virus mit Lipoproteinen beitragen. Daneben sollen verbesserte Vorgehensweisen für die Gewinnung möglichst reifer Hepatozyten in vitro entwickelt werden.
Die Infektion mit HCV ist ein erhebliches medizinisches und gesundheitspolitisches Problem; in mehr als 50% der Fälle entwickelt sich eine chronisch-persistierende Infektion, die zu schweren Schädigungen der Leber, zur Entwicklung von Leber-Zirrhose und zur Entstehung eines hepatozellulären Karzinoms führen kann. Die Zahl von einer chronischen HCV-Infektion Betroffenen wird auf weltweit nahezu 150 Millionen Menschen geschätzt. Zwar wurden in den letzten Jahren erhebliche Fortschritte bei der medikamentösen Behandlung der chronischen HCV-Infektion gemacht; jedoch steht trotz intensiver Forschung bislang keine prophylaktische HCV-Impfung zur Verfügung. Die Entwicklung einer HCV-Vakzine wird u. a. durch die vielfältigen Mechanismen erschwert, mit denen HCV einer Immunantwort ausweichen kann (immune escape). Für diese Fähigkeit des Virus und besonders für seine geringe Sensitivität gegenüber neutralisierenden Antikörpern ist u. a. die Assoziation des Virus mit zellulären Lipoproteinen von maßgeblicher Bedeutung.
Für das Verständnis der Rolle von Lipiden, Lipoproteinen und des Lipoprotein-Metabolismus für die HCV-Infektion ist es von entscheidender Bedeutung, Zellmodelle zu entwickeln, die hinsichtlich ihres Lipid- und Lipoprotein-Stoffwechsels humanen Hepatozyten möglichst nahekommen. Im ersten Schritt des Forschungsvorhabens sollen hES-Zellen daher nach gängigen Protokollen in HLC differenziert und die entstehenden Zellen insbesondere hinsichtlich ihres Lipid- und Lipoprotein-Stoffwechsels charakterisiert werden. Zwar wurden HLC bereits in vielen Studien aus hES-Zellen abgeleitet, jedoch wurde bislang der Authentizität des Lipid- und Lipoprotein-Stoffwechsels wenig Aufmerksamkeit gewidmet. Bereits diese Arbeiten können daher neue Erkenntnisse darüber erbringen, inwieweit aus pluripotenten Stammzellen abgeleitete HLC einen intakten Lipid- und Lipoprotein-Stoffwechsel aufweisen. Da die verwendeten Protokolle im Hinblick auf die Herstellung von Zellen mit einem möglichst reifen Lipid- und Lipoprotein-Stoffwechsel optimiert werden sollen, könnten im Ergebnis der genehmigten Forschungsarbeiten auch verbesserte hepatische Differenzierungsprotokolle verfügbar werden.
HLC sollen dann hinsichtlich ihrer Fähigkeit untersucht werden, eine (produktive) HCV-Infektion zu unterstützen. Insbesondere soll überprüft werden, ob dieses Zellsystem die Produktion von HCV-Partikeln ermöglicht, die eine authentische Beladung der Virus-Partikel mit (zellulären) Lipoproteinen aufweisen. Dabei soll zunächst überprüft werden, in welchem Maße HLC die Virusreplikation unterstützen, wie hoch die Infektiosität der produzierten Viren ist und welche Lipid- und Lipoprotein-Komponenten die von HLC produzierten HCV-Partikel enthalten. Zudem soll bestimmt werden, welche Rezeptoren für die Infektion mit HCV erheblich und welche (bekannten) Kofaktoren involviert sind. Im Ergebnis der Arbeiten soll ein auf HLC basierendes Zellmodell für die HCV-Infektion verfügbar sein, was von erheblicher Bedeutung für die weitere Erforschung der Grundlagen der HCV-Infektion sein könnte. Im folgenden soll dann die Produktion von Komponenten des Lipid- und Lipoprotein-Stoffwechsels in HLC verringert oder ausgeschaltet und der Effekt auf die Eigenschaften der von diesen Zellen produzierten HCV-Partikel detailliert untersucht werden. Diese Arbeiten können voraussichtlich Rückschlüsse darauf zulassen, in welchen Stadien der HCV-Infektion bestimmte Genprodukte möglicherweise essentiell sind, und so zur Identifizierung zellulärer Faktoren beitragen, die die Effektivität einer HCV-Infektion ggf. bestimmen oder modulieren. Dies kann neue Erkenntnisse über Kofaktoren der HCV-Infektion erbringen, was wiederum ggf. zur Identifizierung von Angriffspunkte für neue antivirale Therapien beitragen kann. In diesem Zusammenhang soll auch der Frage nachgegangen werden, ob und in welchem Maße sich die Infektiosität von HCV-Partikeln, die von den Wildtyp- bzw. genetisch veränderten HLC produziert werden, durch neutralisierende Antikörper vermindern lässt. Auf diesem Wege könnten zum einen Bereiche der HCV-Hüllproteine identifiziert werden, die mit den jeweiligen Genprodukten interagieren, bzw. solche Epitope auf der Virusoberfläche bestimmt werden, die nicht mit Lipoproteinen interagieren und somit einer Bindung durch neutralisierende Antikörper ggf. besser zugänglich sind. Zum anderen könnten auf diesem Wege zelluläre Kofaktoren von HCV identifiziert werden, die die humorale Immunantwort gegen das Virus beeinträchtigen. Erkenntnisse dieser Art wären von großer Relevanz für die künftige Entwicklung einer vor der HCV-Infektion schützenden Vakzine.
Weitere genehmigte Forschungsarbeiten zielen auf die Optimierung von hepatischen Differenzierungsprotokollen für die Gewinnung möglichst reifer HLC aus hES-Zellen durch Nachbildung der hepatischen Nische, durch die Nutzung verschiedener extrazellulärer Matrizes oder durch Differenzierung in 3D. Diese Arbeiten können ebenfalls dazu beitragen, ein für die Untersuchung der HCV-Infektion gut geeignetes In-vitro-Modell zu etablieren. Angesichts der Tatsache, dass die meisten der derzeit verwendeten hepatischen Differenzierungsprotokolle zu Zellen eines eher fötalen Phänotyps führen, ist die In-vitro-Gewinnung reifer menschlicher Hepatozyten von großer Relevanz nicht nur für die Etablierung eines Zellmodells für die HCV-Infektion, sondern beispielsweise auch für die Erforschung der Wirkung von Arzneimitteln auf Leberzellen, für die Untersuchung der Metabolisierung von Medikamenten und Umweltchemikalien oder für die Bestimmung hepatotoxischer Effekte von Wirkstoffen.
5. Notwendige Vorarbeiten und Erforderlichkeit der Verwendung von humanen embryonalen Stammzellen für die mit dem Vorhaben verfolgten Fragestellungen
Im Antragsverfahren wurde dargelegt, dass das Projekt in allen wesentlichen Punkten ausreichend vorgeklärt ist.
Fragen der Wechselwirkung von HCV mit Wirtszellfaktoren und insbesondere mit zellulären Lipoproteinen sind in der Vergangenheit bereits umfangreich untersucht worden. Demnach sind zelluläre Lipoproteine sowie am Fettstoffwechsel beteiligte Proteine für alle Schritte der HCV-Infektion – von der Bindung an die Wirtszelle bis hin zur Reifung und Freisetzung infektiöser Partikel – essentiell. Die Assoziation von im Blutkreislauf befindlichem HCV mit Lipoproteinen ist ebenfalls gut etabliert. Für die wesentliche Rolle, die die Assoziation von HCV mit zellulären Lipoproteinen für den immune escape des Virus spielen, liegen in der Literatur ebenfalls Belege vor. Die Tatsache, dass aus hES-Zellen abgeleitete HLC einer Infektion mit HCV zugänglich sind und folglich als HCV-Zellmodell genutzt werden können, ist durch entsprechende Studien bereits belegt worden. HCV durchläuft in hES-Zell-abgeleiteten HLC den gesamten Replikationszyklus, von der Infektion der HLC bis hin zur Freisetzung viraler Partikel. Unter Nutzung von hES-Zell-abgeleiteten HLC wurde ferner gezeigt, dass sich differenzierende Hepatozyten ab dem Hepatoblasten-Stadium für eine HCV-Infektion permissiv sind. In einer weiteren Studie wurden hES-Zell-abgeleitete HLC in immundefiziente Mäuse transplantiert und auf dieser Basis ein funktionales HCV-Infektionsmodell etabliert.
Auch hinsichtlich der geplanten Weiterentwicklung von Differenzierungsprotokollen liegen hinreichende Vorklärungen vor. In der Vergangenheit wurden beispielsweise verschiedene Studien publiziert, in denen der Effekt der Kokultur von sich hepatisch differenzierenden pluripotenten Stammzellen mit verschiedenen Typen anderer in der Leber präsenter Zellen auf die Differenzierung und Reifung zu hepatischen Zellen untersucht wurde. So fördert die Anwesenheit endothelialer Zellen die hepatische Spezifizierung, und parakrine Signale, die von spezifischen Subpopulationen humaner mesenchymaler Zellen erzeugt werden, verstärken die Reifung von Lebervorläuferzellen erheblich. Auch verschiedene Materialien für extrazelluläre Matrizes (ECM) wurden bereits auf ihre Fähigkeit hin untersucht, die Differenzierung von HLC aus hES-Zellen zu unterstützen. Eine Vorgehensweise für die Herstellung von Leberknospen aus pluripotenten Stammzellen wurde ebenfalls bereits publiziert.
Im Antragsverfahren wurde ferner dargelegt, dass sich der mit dem Forschungsvorhaben angestrebte Erkenntnisgewinn voraussichtlich nur unter Verwendung von hES-Zellen erreichen lässt.
Eine Erreichung der Forschungsziele unter Nutzung tierischer Zellmodelle ist nicht möglich, da HCV – mit Ausnahme von Zellen des Schimpansen – ausschließlich menschliche Zellen infizieren kann. Andere menschliche Zellen als pluripotente Stammzellen können zur Erreichung der Forschungsziele ebenfalls nicht verwendet werden. Primäre humane Hepatozyten (PHH) sind zwar das derzeit bestgeeignete Zellmodell für die Infektion mit HCV, jedoch ist ihre Verfügbarkeit begrenzt; zudem sind ihre Charakteristika teils in hohem Maße von der jeweiligen Präparation abhängig, so dass die erforderliche Reproduzierbarkeit und Standardisierbarkeit der Ergebnisse nicht zu gewährleisten sind. Fötale menschliche Leberzellen können aus abgetriebenen Föten zwar gewonnen werden, sind jedoch nicht in für die Projektdurchführung ausreichender Menge sowie nicht in reproduzierbarer und standardisierbarer Qualität verfügbar. Immortalisierte humane Leberzellen bzw. Zellen aus Lebertumoren (insbesondere HuH7.5 und weitere Derivate von HuH7) wurden und werden zwar als Zellmodell für die HCV-Infektion verwendet. Derartige Zell-Linien weisen jedoch in vielerlei Hinsicht nicht das metabolische Profil und andere Eigenschaften reifer Hepatozyten auf. Sie haben insbesondere bezüglich ihrer Ausstattung mit Komponenten des Lipid- und Lipoprotein-Metabolismus offenbar erhebliche Defizite, was Fragen nach der Authentizität der Lipid-Beladung von in solchen Zellen produzierten HCV-Partikeln aufwirft und diese Zellen für die Nutzung in den hier genehmigten Forschungsarbeiten ungeeignet macht.
Auch dafür, dass die Forschungsziele unter ausschließlicher Nutzung von hiPS erreicht werden könnten, liegen derzeit keine ausreichenden Belege vor. Zwar konnten aus hiPS-Zellen abgeleitete HLC in einigen Studien erfolgreich mit HCV infiziert werden, jedoch bestehen weiterhin offene Fragen hinsichtlich der hepatischen Differenzierungsfähigkeit von hiPS-Zellen. Zum einen ist bekannt, dass erhebliche Unterschiede in der Fähigkeit verschiedener hiPS-Zell-Linien bestehen, sich in hepatische Zellen zu differenzieren, was offenbar durch Unterschiede in der Herkunft des somatischen Materials begründet sein kann, aus dem die hiPS-Zellen abgeleitet werden. Beispielsweise waren lt. einer publizierten Studie nur sieben (von 28 untersuchten) hiPS-Zell-Linien einer hepatischen Differenzierung mit Standardmethoden überhaupt zugänglich. Zum anderen liegen teils widersprüchliche Resultate hinsichtlich des metabolischen Profils der aus hiPS-Zellen differenzierten HLC vor.
nach oben