Parakokzidioidomykose
Erreger
Paracoccidioides brasiliensis und Paracoccidioides lutzii sind thermal dimorphe Pilze und Erreger der Parakokzidioidomykose, einer in Südamerika endemischen Systemmykose. P. brasiliensis besteht aus mindestens vier Linien mit unterschiedlicher geographischer Verteilung: S1 (weit verbreitet in Südamerika), PS2 (Brasilien, Venezuela), PS3 (Kolumbien) und PS4 (Venezuela). Infektionen durch P. lutzii werden im mittleren Westen Brasiliens diagnostiziert. Die Pilze werden selten aus Erde angezüchtet wo sie als Myzel vorliegen. Isolation aus klinischen Proben und von Tieren (Amardillos, Hunden, Fledermäusen) benötigt lange Inkubationszeiten und Medien die schnell wachsende Mikroorganismen unterdrücken.
Verbreitung
Die meisten Infektionen werden in Brasilien diagnostiziert, vor allem bei Landarbeitern diagnostiziert. Weitere endemische Regionen liegen in Kolumbien, Venezuela, Peru, Uruguay, Paraguay, Bolivien, Guadeloupe und Teilen Argentiniens.

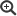 Abbildung 1: Hauptendemiegebiete der Parakokzidioidomykose in Südameria. Aufgrund schwieriger Diagnosestellung und Anzucht aus der Umwelt sowie eingeschränkter serologischer Diagnostik ist die Erkrankung vermutlich in weiteren Ländern endemisch (siehe Verbreitung).
Abbildung 1: Hauptendemiegebiete der Parakokzidioidomykose in Südameria. Aufgrund schwieriger Diagnosestellung und Anzucht aus der Umwelt sowie eingeschränkter serologischer Diagnostik ist die Erkrankung vermutlich in weiteren Ländern endemisch (siehe Verbreitung).
Infektionsweg
Der Erstkontakt mit den Erregern scheint im zweiten Lebensjahrzehnt zu erfolgen. Klinische Manifestationen in diesem Alter sind selten. Symptome werden meist zwischen dem 30 und 50 Lebensjahr überwiegend bei Männern vermutlich nach Reaktivierung latenter Infektionen nachgewiesen. Betroffen sind überwiegend Menschen ohne Immundefekt.
Dauer der Inkubation
sehr variabel, von 1 Monat bis zu Jahrzehnten
Symptomatik
Bei der akuten (juvenilen) Form zeigen sich über Wochen bis Monate progrediente Infektionen die verschiedenste Organsysteme betreffen können. Lymphadenopathie, Hepato-, Splenomegalie, kutane und mukosale-, sowie Knochen-, seltener Lungenläsionen werden beschrieben bei 30-40 Jahre alten Betroffenen. Dazu können Fieber, Gewichtsabnahme kommen. Eine Eosinophilie kann nachweisbar sein.
Die häufigere chronische (adulte) Form wird überwiegend bei Männern zwischen dem 30 und 60 Lebensjahr diagnostiziert mit Beteiligung der Lungen, von Haut-, und Schleimhäuten überwiegend des oberen Verdauungstraktes. Beteiligung des ZNS und weiterer Organsysteme sind möglich. Dazu können Gewichtsabnahme, Nebenniereninsuffizienz vorliegen.
Übergänge zwischen diesen beiden Formen sind möglich. Auch nach Therapie können Funktionsstörungen betroffener Organe persistieren..
Diagnostik
Eine Bluteosinophilie kann bei Patienten aus Endemiegebieten mit möglicher Exposition ein Hinweis für eine Parakokzidioidomykose sein.
Mikroskopie: Ein lichtmikroskopischer Nachweis typischer Erregerformen (Hefezellen mit multipolarer Sprossung) aus dem Sputum, Exsudat oder Eiter kann diagnostisch sein. Die histologische Aufarbeitung von Biopsien (Grocott-Gomori-Färbung) erlaubt ebenfalls die Darstellung der Hefeformen.
Kultur: Die Erregeranzucht kann mehrere Wochen dauern und spezielle Medien erfordern um schneller wachsende Mikroorganismen zu inhibieren. PCR und Sequenzierung können den Erregernachweis beschleunigen.
Serologie: Nachweis präzipitierender Antikörper mittels Immundiffussion benutzen meist das gp43 Antigen von P. brasiliensis. Kreuzreaktionen mit anderen Systemmykosen sind möglich. Infektionen durch P. lutzii können mit den kommerziell verfügbaren Tests übersehen werden.

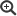 Abbildung 2: Links: Mikroskopischer Nachweis multipolar schmalbasig sprossender Hefe-zellen im Grocottpräparat. Mitte: Wachstum von Hefezellen auf BHI Blut Agar bei 37°C Rechts: Anzucht der Schimmelpilzform bei 26°C.
Abbildung 2: Links: Mikroskopischer Nachweis multipolar schmalbasig sprossender Hefe-zellen im Grocottpräparat. Mitte: Wachstum von Hefezellen auf BHI Blut Agar bei 37°C Rechts: Anzucht der Schimmelpilzform bei 26°C.
Therapie
Itraconazol ist Mittel der Wahl. Bei klinisch schweren Fällen initial Amphotericin B.
Prophylaxe, Immunität
Eine spezifische Prophylaxe ist nicht möglich.
Differentialdiagnose
Tuberkulose (in 10-25% koexistent). Histoplasmose, Coccidioidomykose, Leishmaniose, Lepra, Lues, Neoplasien, Lobomykose, Tumoren.
Gesetzliche Regelungen
Keine Meldepflicht; Paracoccidioides brasiliensis gehört jedoch zur Risikogruppe 3.
nach oben








